doi: 10.56294/hl202296
ORIGINAL
Comparative study of the use of antihypertensives and their relationship with sars-cov-2
Estudio comparativo del uso de antihipertensivos y su relación con sars-cov-2
Franklin Francisco Castro Mindiola1, Pilar Asunción
Soledispa Cañarte1 ![]()
1Universidad de Guayaquil, Facultad de Ciencias Químicas. Guayaquil, Ecuador.
Citar como: Castro Mindiola FF, Soledispa Cañarte PA. Comparative study of the use of antihypertensives and their relationship with sars-cov-2. Health Leadership and Quality of Life. 2022; 1:96. https://doi.org/10.56294/hl202296
Enviado: 23-07-2022 Revisado: 11-10-2022 Aceptado: 05-12-2022 Publicado: 06-12-2022
Editor:
PhD. Prof. Neela Satheesh ![]()
ABSTRACT
This comparative study analyzed the published scientific evidence about the association between the reduction of severity or mortality due to COVID-19, and the efficiency of the use of Angiotensin Converting Enzyme Inhibitors (ACEIs) and angiotensin receptor blockers (BRAs) compared to other drugs antihypertensives non-ACEI/ARB in hypertensive patients.
The objective was to estimate the occurrence of the risk of morbidity, severity or mortality due severe acute respiratory failure in hypertensive patients and the efficacy of angiotensin-converting enzyme (ACE) and inhibitor drugs non-peptic Angio II receptor antagonists (ARBs II) in SARS-Cov-2.
The methodology used was the exhaustive bibliographic review of literary bases through the advanced search function of observational studies, clinical trials and meta-analyses that focus on the use of ACE Inhibitors/BRAs in SARS-Cov-2.
The ACEI and ARB results demonstrated better efficacy in terms of control of inflammatory processes and low risk of severity due to COVID-19 than CCBs. In addition, several studies affirm that there is a low risk of hospitalization, intubation and mortality from all cardiovascular causes during COVID-19 disease. Therefore, published scientific evidence suggests acceptable safety of the management of ACEIs / ARBs in SARS-Cov-2 and arterial hypertension in contrast to the few studies where ACEIs / ARBs increased the susceptibility of SARS-Cov-2, resulting in potential systemic damage.
In conclusion the medium-low quality of scientific evidence suggests an urgent need for a new systematic review that includes a greater number of randomized clinical trials, to corroborate the magnitude of the risk of morbidity, severity, and mortality from SARS-Cov-2.
Keywords: Angiotensin Converting Enzyme Inhibitors; Angiotensin; Receptor Blockers; Coronavirus Disease 2019; Cardiovascular Disease.
RESUMEN
Este estudio comparativo analizó la evidencia científica publicada acerca de la asociación entre la reducción de la severidad o mortalidad por COVID-19, y la eficiencia del uso de los Inhibidores de la Enzima Convertidora de Angiotensina (IECAS) y bloqueadores de los receptores de angiotensina (BRAs) comparado con otros antihipertensivos no IECAS/ BRAs en hipertensos.
El objetivo fue estimar la ocurrencia del riesgo de morbilidad, severidad o mortalidad por insuficiencia respiratoria aguda grave en pacientes hipertensos y la eficacia de los fármacos inhibidores de la enzima convertidora de la angiotensina (IECA) y los antagonistas no pépticos de los receptores de la Angio II (ARA II) en SARS-Cov-2.
La metodología utilizada fue la revisión sistemática exhaustiva de bases literarias mediante la función de búsqueda avanzada de estudios observacionales, ensayos clínicos y metaanálisis que se enfoquen sobre el uso de IECAS/ BRAs en SARS-Cov-2.
Los resultados IECAs y BRAs demostraron mejor eficacia en términos de control de procesos inflamatorios y bajo riesgo de severidad por COVID-19 que los BCCs. Además, diversos estudios afirman que existe bajo riesgo de hospitalización, entubación y mortalidad por todas las causas cardiovasculares durante la enfermedad por COVID-19. Por consiguiente, la evidencia científica publicada sugiere una seguridad aceptable del manejo de IECAs/BRAs en SARS-Cov-2 e hipertensión arterial en contraste con los pocos estudios donde los IECAs/BRAs incrementaban la susceptibilidad del SARS-Cov-2, lo que ocasionaría un potencial daño sistémico.
En conclusión la calidad media-baja de evidencia científica, sugiere una urgente necesidad de una nueva revisión sistemática que incluya mayor número de ensayos clínicos randomizados, para corroborar la magnitud del riesgo de morbilidad, severidad, y mortalidad por SARS-Cov-2.
Palabras clave: Inhibidores de la Enzima Convertidora de Angiotensina; Bloqueadores de los Receptores de Angiotensina; Enfermedad por Coronavirus 2019; Enfermedad Cardiovascular.
INTRODUCCIÓN
La llegada del nuevo coronavirus SARS-CoV-2 (enfermedad por coronavirus 2019; anteriormente 2019-nCoV), que vio su inició en la provincia de Hubei de la República Popular China, se ha extendido por todo el mundo, sorprendió a muchos. El 11 de marzo de 2020, la organización mundial de la salud atreves de su Director el doctor Tedros Adhanom Ghebreyesus declaró la enfermedad como una pandemia, por la alta tasa de mortalidad registrada.
Estudios revelan que la hipertensión, diabetes, las enfermedades cerebrovasculares y la cardiopatía isquémica son comunes entre los pacientes que han desarrollado neumonía grave por SARS-COV-2. Las investigaciones revelan que el nexo causal seria la disfunción y daño miocárdica producida por el virus asociada a la alteración de los inhibidores de la enzima convertidora y los bloqueantes del receptor de angiotensina 2.(1,2,3,4,5,6)
Estudios refieren que cerca del 30 % de casos con mortalidad por SARS-COV-2 en Italia (N=1625 pacientes) presentaron enfermedad coronaria mientras que, en China, la mortalidad por SARS-COV-2 asociada con hipertensión se determinó en 6 % de la población vs 75 % de casos de hipertensión ocurridos en Italia.(1,7,8,9,10) Hallazgos muy similares se encontraron en Italia y EE. UU, donde se determinó que la prevalencia de hipertensión en pacientes con neumonía severo por COVID 19 internados en una unidad de cuidado intensivos fue de 40 % de los casos, seguida de enfermedad cardiovascular (29 %).(1,11,12,13,14,15)
Estudios sugieren que el uso de los inhibidores de las enzimas convertidora de la angiotensina (IECA) y los bloqueadores de los receptores de la angiotensina (BRA) como terapia para las enfermedades cardiovascular e hipertensión en adultos con neumonía por SARS-COV-2 debería llevarse con precaución,(16,17,18) debido a la alta tasa de mortalidad en pacientes hospitalizados.(13,19,20,21) Sugiriendo que existe un elevado riesgo crudo asociado a neumonía severa por COVID-19 con uso de antihipertensivos que en aquellos que no usaban antihipertensivos.(16,19,22,23)
Por otro lado, otros estudios refieren que la terapéutica prioritaria para el manejo y monitoreo de la hipertensión de pacientes adultos con COVID-19 son los inhibidores de las moléculas del sistema de renina angiotensina aldosterona tales como los BRA y bloqueadores de los canales de calcio (BCC),(24) además de los IECAs.(6)
Estudios experimentales han demostrado que el SARS-COV-2 emplea los receptores de las enzimas convertidoras de la angiotensina 2 (RECA2), una aminopepdidasa expresada en pulmón, corazón y riñón, para ingresar a las células; los IECAs y BRA, no han demostrado una asociación con cuadros severos de insuficiencia respiratoria aguda por COVID-19.(6,7)
Adicionalmente, la infección severa por SARS-COV-2 puede reducirse al emplear estos fármacos antihipertensivos,(24) cuya sugerencia es aprobada por la comunidad científica.(7,25,26)
Factores de riesgos asociados con casos severos de COVID-19 con mal pronóstico entre los pacientes hospitalizados en estados iniciales fueron la edad avanzada, elevado puntaje de evaluación secuencial de insuficiencia orgánica (ESIO o SOFA siglas en inglés), y el dimero D mayor de 1µg/ml,(19) así como la falta de adherencia farmacológica a su tratamiento antidiabético y antihipertensivo.(27)
¿Cuáles son las diferencias existentes de los efectos farmacológicos entre los inhibidores de la enzima convertidora de la angiotensina (IECA) y/o los antagonistas no pépticos de los receptores de la Angio II (ARA II) en el tratamiento clínico- farmacológico de los pacientes con hipertensión durante la insuficiencia respiratoria aguda causada por SARS-Cov-2, asociadas con el riesgo de morbilidad, severidad o mortalidad por COVID-19?
Objetivo
Estimar la ocurrencia del riesgo de morbilidad, severidad o mortalidad por insuficiencia respiratoria aguda grave por COVID-19 en pacientes hipertensos y la eficacia de los fármacos inhibidores de la enzima convertidora de la angiotensina (IECA) y los antagonistas no pépticos de los receptores de la Angio II (ARA II) en SARS-Cov-2.
MÉTODO
Este estudio de revisión sistemática comprende el análisis de las bases terciarias para la recopilación de evidencia acreditada en revistas científicas internacionales de alto impacto con el objetivo de sintetizar los avances más novedosos y nuevos conocimientos así como descubrimientos realizados en el tratamiento antihipertensivo de los pacientes con infección por SARS-Cov-2.
Población y muestra: Se seleccionaron artículos científicos publicados en revistas científicas médicas internacionales de alto impacto especialmente sobre estudios epidemiológicos observacionales tales como estudios caso-control, cohortes, estudios experimentales, así como revisiones sistemáticas y metaanálisis.
Por otro lado, la información científica de la farmacocinética y farmacodinamía, así como la fisiopatología de las alteraciones anatómicas, fisiológicas y de los receptores celulares fueron obtenidos de libros impresos altamente reconocidos a nivel internacional, en el campo de la medicina. Todas las referencias bibliográficas son de un tiempo no mayor a 5 años de antigüedad.
|
Tabla 1. Operacionalización de las variables |
|||
|
Variable |
Conceptualización |
Indicador |
|
|
Dependiente |
Ventajas relacionadas a los antihipertensiv os de la familia IECAS y ARA II |
Ventajas identificadas (asociación estadística) en los estudios observacionales, así como estudios terciarios (metaanálisis) |
Efectividad (asociación positiva) de los IECAS vs ARA II Seguridad de los IECAS vs ARA II /BRAs |
|
Independientes |
Edad |
Adultos entre los 18 a 80 años |
Edad cronológica en años |
|
Sexo |
Género de los participantes |
Masculino Femenino |
|
|
Consumo de cigarrillo |
Exposición al humo del cigarrillo Número de cigarrillos consumidos por día o semana |
Fumador pasivo Fumador activo Fumador reciente o actual (ha fumado un cigarrillo en los últimos 30 días) Fumador crónico (que fuma varios cigarrillos por día o semana) |
|
|
|
Terapia antihipertensiva |
Uso de medicamentos antihipertensivos pertenecientes a la familia IECAs o ARAs II/ BRAs o BCCs |
Monoterapia Politerapia |
|
|
|||
|
Terapia antiagregante plaquetarios o/y anticoagulante |
Uso de medicamentos que inhiben la agregación plaquetaria o/y anticoagulante |
Ácido acetil salicílico Clopidogrel Warfarina |
|
|
SARS-Cov -2 |
Nivel de severidad del Síndrome Respiratorio Agudo por coronavirus tipo 2 |
Poco severo Muy severo |
|
|
Biomarcadores serológicos de inflamación |
Elevación de las Citoquinas Elevación de las proteínas C reactivas |
Interleucinas (IL6) PCR cuantitativo |
|
|
Elevación del Dimero D |
Dimero D |
||
|
Elevación de la Ferritina |
Ferritina |
||
|
Obesidad |
Índice de masa corporal (IMC) calculado por peso en kg/talla en metros cuadrados |
Obesidad grado I (IMC 30,0-34,9) Obesidad grado II (IMC 35,0-39,9) Obesidad grado III (IMC igual o mayor a 40,0) |
|
|
Insuficiencia hepática severa |
Elevación de las enzimas hepáticas |
Si No |
|
|
Insuficiencia renal severa o fallo renal |
Elevación de la creatinina en sangre y daño renal mayor o igual a tres meses con una tasa de filtración glomerular menor de 60 ml/min/1,73 m2 (guía K/DOQI, 2002) |
Si No |
|
|
|
Enfermedades degenerativas |
Presencia de enfermedades neurológicas discapacitantes |
Parkinson Alzheimer Ninguna |
|
Diabetes |
Tipo de diabetes mellitus. Dependiente o no de insulina. |
Tipo 1 Tipo 2 |
|
|
Cáncer |
Presencia de neoplasias malignas |
Si No |
|
Hipótesis: las diferencias entre la eficiencia relacionada al uso de los IECAS vs ARA II/ BRAs son significativas o demuestran asociaciones positivas en el tratamiento antihipertensivo de los pacientes con SARS-Cov-2.
Variables independientes: edad (de 18 a 80 años de edad), sexo (H o M), fumador, monoterapias y politerapias antihipertensivas, antiagregantes plaquetarios, severidad de la enfermedad COVID-19. Biomarcadores serológicos de inflamación, presión media arterial, ritmo cardiaco. Historia médica/ antecedentes patológicos personales: obesidad, cáncer, enfermedades degenerativas o neurológicas, insuficiencia hepática, insuficiencia renal.
Variables dependientes: nivel de eficiencia relacionados al uso de los IECAS y ARA II en el tratamiento antihipertensivo.
Técnicas e instrumentos: para el desarrollo de este estudio se empleó como instrumento de recolección de estudios observacionales y terciarios (revisión sistemática y metaanálisis) las bases de datos literarias para obtener todos los artículos completos publicados para cumplir con la investigación propuesta.
Gestión de datos: se seleccionaron artículos científicos publicados en revistas científicas indexadas, de alto impacto, de libre acceso y artículos pagados, disponibles en las bases de datos bibliográficas universales, tales como: PubMed/Medline, Cell, Scopus, ScienceDirect, Google Scholar, Elsevier, Web of Science, Scielo. Información publicada desde el inicio de la pandemia COVID-19 en marzo 2020 hasta julio del 2021, que fue la fecha de corte del estudio. Los resúmenes de las referencias bibliográficas obtenidas mediante la búsqueda usando filtros fueron analizados de manera independiente para identificar los estudios elegibles por los criterios de inclusión. Sólo se tomaron en consideración los artículos completos de acceso libre y pagados.
Adicionalmente, para la búsqueda exhaustiva de la literatura en los navegadores o bibliotecas (bases primarias) se empleó “palabras claves en MeSH” o “términos de búsqueda” avanzada, empleando los operadores del sistema booleano tales como AND, OR y NOT (en español y, o y no, respectivamente). Con estos descriptores y las preposiciones establecieron los límites de consultas en las bases bibliográficas mediante las palabras claves “antihypertensive drugs/medicine” AND “SARS-Cov-2” or “COVID-19”; “ACE” AND “COVID-19”; “angiotensin converting enzyme inhibitors” (IECAS) AND “SARS-Cov-2”; “angiotensin receptor bloquers” (ARA II/BRAs) AND “SARS-Cov-2”; “Comparison of antyhipertensive outcomes of patient with COVID-19” AND “primary hypertension”.
En la búsqueda avanzada con las palabras claves mencionadas en la parte superior, la búsqueda exhaustiva en las bases literarias Google Scholar, Elsevier, Web of Science, y Scielo se encontraron 333 artículos publicados. Al realizar procesos de cualificación de los artículos a través de los criterios de inclusión y exclusión se obtuvieron 8 artículos científicos en las bases de datos literarias en idioma inglés.
De Pubmed.gov Search, con las palabras claves “covid 19” AND “antihypertensive” se encontraron 271 artículos, entre artículos publicados completos de acceso libre, y sin acceso libre y otros que eran resúmenes en línea. Se filtró por artículos publicados completos de acceso libre, y sin acceso libre quedando un total de 226, posteriormente se filtró por tipo de estudio, y se escogieron aquellos estudios ensayos clínicos, estudios aleatorios controlados, metaanálisis, pero no revisiones sistemáticas puras,(2) quedando un total de 14 artículos publicados.
De Science Direct y Cell, se filtró en búsqueda avanzada con la palabra “COVID” AND “antihipertensivo”, obteniéndose un total de 720 artículos científicos de alto impacto, publicados de manera completa, de acceso libre, y sin acceso libre, entre el año 2020-2021, que posteriormente fueron filtrados por el área de estudio en química, genética y medicina molecular, así como medicina, quedando un total de 212 artículos, de los cuales solo dos estudios cumplieron los criterio bioquímico/médico de inclusión.
En general, al realizar procesos de cualificación de los artículos a través de los criterios de inclusión y exclusión se obtuvieron un total de 19 artículos científicos en las bases de datos literarias en idioma inglés, que incluyen estudios observacionales, estudios experimentales controlados y estudios terciarios (metanálisis).
Adicionalmente, cerca de 7 estudios experimentales randomizados de la base literaria PUBMED/MEDLINE aún no han revelado sus resultados o conclusiones sobre si existe o no un incremento de riesgo de severidad, morbilidad, o mortalidad causado por el uso de IECAS/BRAs en pacientes con hipertensión y población general que padece de SARS-Cov-2.
Viabilidad del estudio: el carácter de esta investigación es viable debido a que toda la información obtenida proviene de datos científicos publicados en revistas científicas de alto impacto a nivel mundial, cuya contenido científico tiene una alta legitimidad y calidad científica.
Técnica del análisis: los hallazgos científicos y relevantes obtenidos de los estudios científicos observacionales y estudios terciarios tales como revisión sistemática y metaanálisis están tabulados en una tabla de resumen para estudios de revisión sistemática, la misma que sintetiza las características principales de cada artículo seleccionado.
Se realizó una comparación de los diferentes resultados significativos de dichos estudios, cuyo análisis nos permitirá establecer recomendaciones y conclusiones acorde con el grado de evidencia científica, empleando el sistema GRADE (Sistema de Graduación de la Evidencia y Recomendación Científica),para lo cual se empleó la GRADEproGDT (https://gdt.gradepro.org).
Criterios de inclusión:
· Estudios observaciones: caso-control, cohorte, ensayos clínicos con análisis doble ciego
· Estudios de análisis terciario: revisión sistemática y metaanálisis
· Estudios que incluyan personas infectadas con SARS-Cov-2 pero con hipertensión arterial primaria con una presión sistólica (PS) de 130-140 mmHg y una presión diastólica (PD) de 85-90 mmHg, recientemente diagnósticados (≤5 años de evolución).
· Grupos de estudios que presenten los factores asociados a un evento neumómico grave por COVID-19 o SARS-Cov-2
· Grupos de estudios relacionados al periodo de publicación entre marzo 2020 a agosto del 2021
· Estudios con neumonía moderado, y grave o severo esta última que cumpla los siguientes criterios de recuento de riesgos o factores de riesgos >3 o OR>3 durante la admisión hospitalaria (cada uno equivalente a 1 punto) como son puntaje de severidad radiológica >3, hipertensión, diabetes, sexo masculino, etnicidad (raza no blanca), neutrofilos :8,0x109/L, edad >40 años, PCR >40 mg/dL y saturación de oxígeno menor de 93 % sentado.(49)
Criterio de exclusión:
· Grupo de estudios observacionales que incluyan pacientes.
· Grupo de estudios en que empleen participantes con antecedentes de hipertensión primaria severa (PS ≥141 mmHg y PD ≥96 mmHg o hipertiroidismo, cateterismo cardiaco o disfunción cardiaca atendidas 5 años antes de la infección por COVID-19.
· Grupo de estudios en que se incluyan personas con diabetes mellitus tipo 1 o tipo 2, Insuficiencia renal, o enfermedad obstructiva crónica (EPOC) o enfermedades autoinmunes u obesidad mórbida (obesidad grado III) atendidas 5 años antes de la infección por COVID-19.
· Estudios que no contengan registro médico de antecedentes patológicos personales que puedan dar confusión o sesgo de selección por la presencia de enfermedades concomitantes asociadas con mortalidad (ej. cáncer, inmunodepresión severa).
· Estudios cuyo manejo de la terapia antihipertensiva se encuentre asociada a una estrategia no farmacológica.
Criterios éticos de la investigación: Este estudio de revisión sistemática incluyó solo estudios que han sido aprobados por comité de ética institucional. Con énfasis a la confidencialidad de la información personal de los pacientes. Los estudios randomizados cumplieron a cabalidad con consentimiento informado con cláusulas de abandono del estudio por derecho irrenunciable en caso de efectos tóxicos o severos de los antihipertensivos durante la enfermedad grave por COVID-19.
Definición de severidad de enfermedades por COD-19: Los siguientes criterios definen síndrome respiratorio agudo severo por coronavirus tipo 2 (SARS-Cov-2) o severidad de la enfermedad por coronavirus 2019 (COVID-19) tales como frecuencia respiratoria > 30 respiraciones por minuto; estrés respiratorio severo o saturación de oxígeno <92 %, porcentaje de compromiso pulmonar >50 % de infiltración pulmonar entre 24-48 horas.(50,51) Adicionalmente, PS ≥141 mmHg y PD ≥96 mmHg;(24) y PCR >40 mg/dL.(49)
Mientras que neumonía severa fue definido por fallo respiratorio, shock séptico o compromiso multiorgánico.(51)
RESULTADOS
Diagnostico o estudio de grupo:
Eficacia farmacológica del uso de los IECAs y/o ARA II/ BRAs en pacientes hipertensos o sin hipertensión con insuficiencia respiratoria aguda por COVID-19.
IECAs y BRAs demostraron mejor eficacia en términos de disminución de la presión arterial y control de los procesos inflamatorios y bajo riesgo de severidad por COVID que los BCCs. Candersartán, fue asociado a un tiempo acortado de hospitalización, cuando se realizó un ajuste para los factores de confusión.(45)
Efectos farmacológicos de los IECAs/ARA II o BRAs asociados a la reducción de la hipertensión, mortalidad y severidad de la infección por COVID-19.
Varios estudios demostraron que los IECAs/ARA II o BRAs fueron significativamente asociados (asociación positiva) con bajo riesgo de enfermarse gravemente/ hospitalizarse por SARS-Cov-2,(48,52,63,64) bajo riesgo de entubación(52) y mortalidad(5,47,48,52,61,64,65) por insuficiencia respiratoria grave o neumonía grave o enfermedades cardiovasculares en comparación con otros antihipertensivos no IECAs/no BRAs.(42)
Cuando se comparó IECAs con BRAs, el riesgo de mortalidad o severidad de neumonía fue menor en IECAs que en BRAs.(52,66) Dos estudios de metaanálisis demostraron que los IECAS disminuyen el riesgo de mortalidad y severidad, en contraste con los BRAs que aumentan la severidad de la enfermedad por COVID-19 en adultos menores de 60 años.(66,67) Mientras que dos estudios experimentales randomizados y un metaanálisis de estudios randomizados,(68) así como otros estudios de metaanálisis,(69) no pudieron demostrar una asociación significativa o ninguna diferencia entre aquellos que empleaban IECAs y/o BRAs durante la enfermedad moderada por COVID-19, en términos de incrementar la severidad o mortalidad.(68,69,70,71,72,73,74,75,76)
|
Tabla 2. Estudios observacionales y terciarios relevantes encontrados en las bases literarias |
|||||
|
Autores (Año) |
Diseño de estudio |
Muestra |
Criterios/Pará metros usados |
Resultados relevantes |
Limitaciones del estudio |
|
Semenzat o et al.(52) |
Estudio Cohorte Retrospectivo |
2 millones de pacientes hipertensos |
IECAS ARA II/ BRAs Bloqueadores de los canales de calcio (BCCs) |
La mayoría fueron seguidos por 16 semanas, 526 murieron o fueron entubados por COVID-19. IECAs y BRAs fueron asociados con bajo riesgo de enfermarse gravemente/hospitalizarse de COVID-19 comparado con los BCCs. HR=0,74 [95 % IC, 0,65-0,83] y 0,84 [0,76-0,93],respectivamente, y bajo riesgo de muerte/entubación (asociación positiva). Cuando se comparó IECAs con BRAs, el riesgo fue menor en IECAs que en BRAs. |
Sesgos de colisionador. A pesar de que se trató de realizar grupos homogéneos de comparación de pacientes tratados con antihipertensivos, algunos de ellos no estaban bien definidas sus comorbilidades cardiovasculares para definir claramente el riesgo de COVID-19. Sesgo de indicación fue disminuido, sin embargo, se comparó jóvenes y adultos mayores con monoterapias antihipertensivas (segregándolos en 3 grupos) lo que ocasionó un impacto sobre la asociación del estudio. No todas las personas en este estudio fueron hospitalizadas ni tuvieron diagnóstico positivo de COVID-19. Como efecto colateral de los IECAs: se evitó pacientes que estén tomando por largos periodos de tiempos IECAs debido a la intolerancia de la medicación. Al contrario, no se observó este efecto en pacientes usando BRAs, lo cual no se pudo excluir el sesgo de selección en este grupo (el cual causó asociación negativa). Por ser datos secundarios, no se puede garantizar la toma apropiada de medicación antihipertensiva (todos los días), pero un análisis indirecto de la cantidad de meses en tratamiento sugiere buena adherencia a los antihipertensivos en la mayoría de los pacientes. |
|
Fosfol et al.(48) |
Estudio Cohorte Retrospectivo. Estudio nested caso-control |
4480 pacientes hipertensos |
IECAS/ BRAs (n=895) vs otros antihipertensivos (n=3585) |
En estudio cohorte, el grupo que usó IECAS/BRAs tuvo 18,1 % de muertes vs 7,3 % del grupo de pacientes que no usó IECAS/BRAs con una asociación no significante (HR=0,83, 95 % IC: 0,67-1,03) cuando se ajustó para sexo, edad y los antecedentes patológicos personales. En el análisis no ajustado, los casos severos o muerte por SARS-Cov-2 ocurrieron en aquellos que usaron IECAS/BRAs que en aquellos que no lo usaron (31,9 % vs 14,2 %, respectivamente, (con HR=1,04, 95 % IC: 0,89-1,23) durante un tiempo de 30 días. En el estudio nested caso-control no se observó que IECAS/BRAs tengan una asociación significante de incidencia de SARS-Cov-2 cuando se comparó con el grupo de antihipertensivos no IECAS/BRAs, con HR=1,05, 95 % IC: 0,80-1,36). En el análisis ajustado, IECAS/BRAs no están asociados con el riesgo de severidad o empeoramiento de COVID-19. Adicionalmente se evidencia un efecto beneficioso en la inhibición del SRAA. Por otro lado, los IECAS/BRAs han sido asociados positivamente en el mejoramiento de la neumonía por COVID-19, |
Sesgo de no clasificación debido a que la mayoría de los pacientes con enfermedad cardiovascular grave previa (infarto al miocardio) estaban altamente asociados con mortalidad por SARS-Cov-2. Este estudio no demostró casualidad o no inferencia casual (por ser un estudio observacional, por lo tanto, las relaciones son interpretadas como asociaciones) en la inhibición del SRAA por IECAS o ARA II/ BRAs y susceptibilidad por COVID-19 o empeoramiento de COVID-19. Por otro lado, los datos son datos secundarios colectados en un corto periodo de tiempo, por lo cual existe la posibilidad de sesgo de selección. No todos los casos de COVID-19 fueron confirmados por serología (laboratorio) pero si se determinó la PCR. Pacientes en la muestra fueron diagnosticados a nivel hospitalario (hospitalización y consulta externa) pero sin un diagnóstico definitivo de COVID 19, en su lugar se usó la codificación CIE-10, de alta especificidad, pero baja sensibilidad. No fue confirmada la información del uso diario de la terapia antihipertensiva de manera cotidiana y prolongada y buena adherencia farmacológica. |
|
Zhang et al.(47) |
Estudio multicéntrico retrospective |
1128 pacientes hipertensos |
IECAS/ BRAs (n=188) vs otros antihipertensiv os/ sin IECAS/ BRAs (n=940) |
La edad media fue 64 a/e. El riesgo de mortalidad por SARS-Cov-2 fue baja cuando los pacientes tomaban IECAS/ BRAs que en aquellos que no tomaban, con HR=0,42, 95 % IC: 0,19-0,92) y asociación significante, p=0,03. En el análisis propensity score-matched en el modelo de efecto mixto de Cox, demostró de manera similar el mismo resultado, disminuyendo toda causa de mortalidad, con HR ajustado=0,37, 95 % IC: 0,15-0,89, p=0,03). En este último análisis por subgrupos de antihipertensivos, IECAS/ BRAs fueron asociados con el decrecimiento de la mortalidad por SARS-Cov-2 en pacientes hipertensos, HR ajustado=0,30, 95 % IC: 0,12-0,70, p=0,01). Adicionalmente, los pacientes con enfermedades obstructivas crónicas (EPOC) que toman BRAs tienen menor riesgo de severidad y mortalidad por EPOC |
El estudio no comparo los efectos beneficiosos entre IECAS y BRAs en el mejoramiento clínico de los pacientes con SARS-Cov-2. Solo se tomaron en consideración pacientes hospitalizados en 9 hospitales de China. Por lo tanto, sugiere que debe haber una diferencia sustancial entre los pacientes manejados de manera domiciliaria o por consulta externa y aquellos hospitalizados por hipertensión, además ocurre de igual manera por grupo étnico y distribución geográfica diversa. La muestra de pacientes que tomaron IECAS/ BRAs fue pequeña con poco poder estadístico para observar significativamente los efectos diferentes entre IECAS y BRAs. La naturaleza retrospectiva del estudio permite datos faltantes o no disponibles relacionados a la toma de medicación antihipertensiva intrahospitalaria o constancia de la toma de antihipertensivos. Factores de confusión ingresados por la diferencia en proporción de pacientes que usaron β bloqueantes y diuréticos entre IECAS/ BRAs y el grupo sin IECAS/ BRAs. |
|
Reynolds, et al.(18) |
Estudio Cohorte Retrospectivo |
12594 pacientes hipertensos |
IECAS/ BRAs, BCCs, β bloqueantes |
De la muestra 2,573 pacientes hipertensos con test de COVID-19 positivo, de los cuales [n=634, (24,6 %)] tuvieron severo (incluyen 165 con ventilación mecánica y 343 muertes) y moderado COVID-19 registrados en la unidad de cuidado intensivos, Alrededor de 4,357 pacientes (34,6 %) del total 12,594, eran hipertensos, de quienes 59,1 % tuvieron un examen positivo para COVID-19. Del total 12,500 pacientes ingresados en el estudio con resultados positivo para COVID-19 en Nueva York, se observó que ninguna de las medicaciones antihipertensivas fue asociada con incremento del riesgo de severidad del SARS-Cov-2 ni de incremento de probabilidad de aquellos pacientes que dieron test positivo para COVID-19 relacionado con cada clase de antihipertensivo, especialmente IECAS y BRAs. Por otro lado, se sugiere que el efecto es potencialmente diferente en el riesgo de severidad de COVID-19, por su mecanismo farmacológico diferente en el SRAA, por lo cual se observó una modesta posibilidad de test positivo para COVID-19 en aquellos que usaron β bloqueantes, luego que la muestra fue emparejada (análisis matched) |
Los diagnósticos diversos de exámenes para COVID-19 usados en este estudio dieron origen a sesgo de clasificación errónea. La verdadera sensibilidad de las pruebas aún es desconocida. Algunos de los pacientes tuvieron más de dos pruebas diagnósticas para COVID-19. Se consideró en el estudio una sobreestimación de la proporción de casos de SARS-Cov-2, debido a la alta demanda de varios exámenes diagnósticos de COVID-19 por persona, especialmente en aquellos no hospitalizados, creando un sesgo sistemático en la evaluación entre terapia antihipertensiva y COVID-19. Debido a que los récords médicos fueron récords de salud electrónicos la información no reflejaba la constancia del tratamiento antihipertensivo tomado. |
|
Nouri- Vaskeh, et al.(24) |
Ensayo clínico aleatorio |
Se empleó una muestra (n=41) con Losartán (ARA II) y (n=39) con amlodipina (BCCs) |
Losartán 25 mg dos veces al día (ARA II) vs amlodipina 5 mg por día (BCCs) durante 14 días. |
Tiempo de estadía hospitalaria fue de 4,6±2,6 con losartán y 7,3±8,7 amlodipina. No se demostró una asociación entre la administración de losartán o amlodipina en la reducción del riesgo de mortalidad o severidad en pacientes con COVID-19 positivos con hipertensión primaria, ni hubo variación en el tiempo de estadía hospitalaria con el uso de los antihipertensivos. Además, no se presentaron efectos adversos durante el tratamiento con Losartán y amlodipina, lo cual demuestran la seguridad de los fármacos. Por otro lado, los autores sugieren que los IECAS y ARA II son responsables de incrementar los ACEII (alta expresión de ACE a nivel endotelial y pulmonar), receptores celulares que permiten la adherencia e infiltración del COVID-19 a la célula. Con el uso de Losartán hubo un descenso considerable de linfocitos T entre el inicio del estudio y la alta médica hospitalaria, p=0,18, mientras que en la amlodipina no se observó similar efecto, p=0,41. En ambos grupos de drogas, en las dos fases demostraron una reacción significativa de mejoramiento de la saturación de oxígeno capilar (O2 %) con p<0,005. |
Entre los pacientes hubo 7 años de la media de edad en diferencia lo que podría indicar que mientras más edad tenga el paciente existe un incremento en la posibilidad del riesgo morbilidad y severidad, así como mortalidad por COVID-19. |
|
Abdullah, et al.(50) |
Estudio Cohorte Retrospectivo |
182 pacientes hipertensos |
IECAS/ BRAs (n=91) vs otros antihipertensiv os/ BCCs y β bloqueantes o tiazidas (n=91) |
Se determinó que no hay diferencias significativas de las terapias antihipertensivas especialmente los IECAS/ BRAs o ARA II entre el riesgo de severidad o muerte entre los casos SARS- Cov-2 excepto en la severidad de la infiltración pulmonar en las radiografías estándares de tórax. En pacientes con terapias IECAS/ BRAs que tuvieron >50 % de infiltrado pulmonar fueron menos (n=37, 41,1 %) que aquellos grupos con otros antihipertensivos (n=53, 58,2 %); p=0,020. Los pacientes en el grupo IECAS/ BRAs tuvieron más casos de enfermedad coronaria isquémica (n=30, 33 %) que los otros grupos de antihipertensivos (n=11, 12,1 %); p=0,001. |
El poder estadístico y la muestra son muy pequeños como para observar significativamente los efectos diferentes entre IECAS y BRAs. Se consideró en el estudio una sobreestimación de la proporción de casos de SARS-Cov-2, al incluir más casos severos de enfermedad en grupos sin IECAS/ BRAs que aquellos con IECAS/ BRAs, (n=37, 41,1 % vs n=39, 42,7 %, respectivamente). No fue confirmada la información del uso diario de la terapia antihipertensiva de manera cotidiana y constante, ni cuantos días de toma de la terapia antihipertensiva. Sesgo de no clasificación debido a que la mayoría de los pacientes con enfermedad cardiovascular grave previa (infarto al miocardio) están altamente asociados con mortalidad por SARS-Cov-2 |
|
Wang et al.(53) |
Estudio Cohorte Retrospectivo |
210 pacientes hipertensos |
IECAS/ BRAs (n=81) vs otros antihipertensivos/ sin IECAS/ BRAs (n=129) |
La media de la edad fue 68 y 66 respectivamente. Los pacientes que tomaban IECAS/ BRAs fueron estadísticamente significante y asociados con más casos de altas médicas, y más casos que requerían más días de hospitalización en la unidad de cuidados intensivos (UCI) e incremento de la presión diastólica (PD), p=<0,050. Se determinó que no existe diferencias significativas entre los grupos de antihipertensivos o complicaciones clínicas tales como fluctuaciones de la PD, el radio de supervivencia acumulada, días de estancia en UCI, o severidad de la enfermedad por COVID-19. |
El poder estadístico y la muestra son muy pequeños como para observar significativamente los efectos diferentes entre IECAS y BRAs. No fue confirmada la información del uso diario de la terapia antihipertensiva de manera cotidiana y constante |
|
Zhang et al.(54) |
Meta-análisis |
7 estudios cohorte 5 estudios caso- control |
IECAS vs BRAs en el riesgo de la infección por COVID-19 y progreso de la enfermedad. Extracto de los datos publicados usó metodología doble ciego. La heterogeneida d (I2) del estudio fue >50 %. |
Del total de estudios, cuando se agruparon los estudios por tipos de antihipertensivos, el riesgo de infección por COVID-19 no fue significativo entre aquellos que empleaban IECAS (OR=0,98; 95 % IC: 0,92-1,04) y para BRAs (OR=1,01; 95 % IC: 0,95-1,07) en el desarrollo de la infección por COVID-19. Del total, 9 estudios, 1631 casos de COVID-19 que usaron IECAS/BRAs vs 11 620 pacientes que emplearon otros fármacos no IECAS/BRAs no demostraron diferencias significativas (OR=0,73; 95 % IC: 0,05-1,07; p=0,11) en el incremento de mortalidad por SARS-Cov-19. Por otro lado, 7 estudios que incluyeron 3070 casos que usaban IECAS/BRAs durante la infección por COVID-19 y 3830 pacientes que emplearon otros fármacos no IECAS/BRAs, no demostraron asociación significativa de incremento del riesgo de severidad por COVID-19 (OR=0,95; 95 % IC: 0,83-1,10; p=0,52; I2=57,6 %). |
Sesgo de publicación, puesto que este estudio solo analizó pocas publicaciones de alto impacto lo cual influye sobre la calidad de la evidencia científica. En este estudio la mayor limitación fue el numero residual de los factores de confusión tales como sexo, edad, consumo de tabaco y diabetes. Estos estudios observaron o revisaron récords médicos. Las inconsistencias de las definiciones de severidad de COVID-19, fueron un rasgo muy peculiar entre los estudios. |
|
Ren et al.(55) |
Meta-análisis |
39 estudios cohorte 14 estudios caso- control |
Estratificación por factores de confusión. Se emplearon 40 estudios sobre severidad del COVID-19; 23 de hospitalización , 12 en unidades de cuidados intensivos (UCIs) y 38 estudios de mortalidad. |
De todos los estudios incluidos, no se demostró una asociación significativa con el riesgo de incremento de incidencia de COVID-19 [sin riesgo de incremento] (OR=0,96; 95 % IC: 0,86-1,08; I2=84,4 %); severidad (OR=0,92; 95 % IC: 0,77-1,11; I2=83,1 %); hospitalización (OR=1,09; 95 % IC: 0,91-1,31; I2=70,3 %); admisión a UCIs (OR=1,19; 95 % IC: 0,85-1,66; I2=56,6 %) y mortalidad (OR=0,92; 95 % IC: 0,74-1,13; I2=84,7.%). |
Solo existen estudios observaciones publicados a esa fecha, por lo cual no se identificaron ensayos clínicos controlados. Algunos estudios no demostraron ORs (radio Odds). Además, algunos estudios no ajustaron los factores de confusión como son edad, sexo, y comorbilidades. |
|
Barochine et al.(51) |
Meta-análisis (Argentina) |
18 estudios con 17311 pacientes |
Usó el modelo de efecto ajustado o modelo de efecto aleatorio. Pacientes que usan IECAS/ BRAs |
El análisis combinado concluyo que IECAS/ BRAs no son riesgo de incrementar severidad en COVID- 19, en su lugar tienen un efecto protector en pacientes hipertensos. El uso de IECAS/ BRAs fue asociado positivamente con 16 % de decrecimiento del riesgo de resultados clínicos como muerte, admisión a UCIs, requerimiento de ventilación mecánica o progresión a neumonía severa (RR=0,84; 95 % IC: 0,73-0,95; p=0,007; I2=65,0 %). Controversialmente a este estudio, algunos estudios sugieren que el uso de inhibidores del SRAA incrementan la susceptibilidad del virus al incrementar la expresión de ECA 2, como receptor del COVID-19 para el ingreso a la célula humana.(20,56) Mientras que estudios independientes sugieren un potencial daño en el uso de inhibidores del SRAA, y porque no existe suficiente evidencia de los beneficios que poseen los IECAS/ BRAs durante la terapia de COVID-19. |
Sesgo de publicación. El estudio no separó los efectos de IECAS y BRAs. La mayoría de los estudios incluidos en este estudio fueron observacionales e impresiones, estos últimos considerados por tener baja calidad de evidencia científica. La mayoría de los estudios incluidos fueron retrospectivos, por lo tanto. sesgo de selección de pacientes es más frecuente, así como la inclusión de factores de confusión residuales, por lo que no fueron ajustados por factores de confusión tales como edad y enfermedades cardiovasculares, lo que puede originar un alto riesgo debido a una asociación positiva entre IECAS/ BRAs y COVID-19. |
|
Henry, et al.(57) |
Estudio cohorte retrospectivo (USA) |
1055 participante s admitidos a nivel hospitalario en Texas. |
Uso de IECAS/ BRAs y estatinas en neumonía viral (rinovirus [37 %, influenza A [33 %], y virus sincicial respiratorio [10 %]) de pacientes adultos hospitalizados con neumonía confirmada por proteína C reactiva (PCR) positiva (incrementada) entre el 2011 y 2014. |
Los inhibidores del SRAA incrementan la expresión de la ECA 2, evitan la reducción de la producción de ECA 2 pulmonar inducido por la infección pulmonar, ya sea por internalización viral intracelular o la desregulación de la enzima ACE 2 durante el proceso asociado a la disminución de la secreción de citoquinas que tienen un efecto inflamatorio a nivel pulmonar, causando un efecto protector. Estudio sugiere que el uso continuo de IECAS en neumonía viral está asociada con el decrecimiento del riesgo de muerte o intubación (en UCIs) (OR=0,25; 95 % IC: 0,09-0,64; p<0,01, asociación positiva o efecto protector), además reduce la estadía hospitalaria (OR=0,70; 95 % IC: 0,53-0,91; p<0,01). Este estudio comprobó el riesgo incrementado del uso de antihipertensivos IECAS antes de que los pacientes fueran hospitalizados (OR=3,02; 95 % IC: 1,30-7,01; p=0,01). Sugiriendo/ especulando que talvez se descontinuó el tratamiento IECAS antes de la hospitalización. |
La metodología retrospectiva solo puede demostrar asociación y no casualidad. Los resultados solo demuestran la experiencia de un solo hospital. Adicionalmente, el 20 % de los pacientes ingresados al estudio tuvieron coinfección bacteriana, infraestimando el verdadero efecto bacteriano, antes de empezar un adecuado tratamiento antimicrobiano. El número de PCR virales analizados a partir de un lavado broncoalveolar no estuvieron disponibles. Hubo muchos casos con PCR viral positivos pero pocos resultados positivos de muestras del tracto respiratorio bajo. |
|
Ssentong, et al.(5) |
|
14 estudios con análisis cualitativos y cuantitativo s fueron incluidos; 74 073 pacientes con COVID-19 de las regiones Asia, Europa, y Norte América. |
Uso de IECAS/ BRAs con la asociación de riesgo elevado de mortalidad por COVID- 19. El estudio empleó todas las medidas de asociación como HR, OD, y RR entre la asociación de los inhibidores de SRAA y el riesgo de mortalidad por COVID-19. |
El QoE por GRADE para mortalidad fue calificada con calidad moderada. La media de calificación del estudio de calidad fue de 8/9. Los pacientes que tomaron inhibidores de SRAA tuvieron 35 % menos posibilidad de morir o menos riesgo de mortalidad por COVID-19 que aquellos que no tomaban IECAS/ BRAs durante la hospitalización (RR=0,65; 95 % IC: 0,45-0,95; p<0,01; I2=80,0 %). |
No todos los estudios presentaron RR ajustado, lo que implicó en la subestimación o falta de riesgo de asociación de mortalidad con COVID-19. Como todo estudio metaanálisis, los sesgos de selección son comunas en estudios retrospectivos derivados de récords médicos, por otro lado, por la estricta clasificación de los casos COVID-19 sustentados por RT-PCR positivos al inicio de la pandemia, resultando en perdida de casos y muertes causadas por SARS-Cov-2. |
|
Kerneis, et al.(58) |
Revisión sistemática y análisis ajustado. |
21 estudios; 11 539 participante s, de los cuales 3417 (29,6 %) fueron tratados con BRAs |
Este estudio empleo un análisis ajustado para evaluar el efecto de IECAS/BRAs en todas las causas de mortalidad por COVID-19. |
Por otro lado, un pequeño número de estudios sugieren que BRAs puede alterar la expresión de la ECA 2 afectando la susceptibilidad de SARS-Cov-2. Todas las causas de mortalidad ocurrieron en 17,1 % [587/3417] de los pacientes con COVID-19 que usaban BRAs vs 12,1 % [982/8122] que no usaron BRAs (OR= 1,00, 95 % IC: 0,69-1,45; p=0,49; I2=84,0 %). Después del análisis ajustado no se evidenció que exista un efecto peligroso adverso de los BRAs durante el tratamiento de COVID-19. Este estudio sugiere una seguridad aceptable del uso de BRAs en pacientes con COVID e hipertensión arterial. |
Todos los estudios fueron observacionales. Algunos de ellos solo incluyeron terapia con BRAs otros estudios incluyeron pacientes hipertensos y diabéticos. Este estudio no uso datos de récords médicos. |
|
Ma, et al.(59) |
Revisión sistemática y Metaanálisis China/Australia |
IECAS/BR As en pacientes hipertensos y no hipertensos con COVID-19 |
16 estudios caso-control [N=116 111] que examinan el efecto de IECAS/BRAs. De los cuales, 8 estudios evaluaron IECAS/BRAs e incidencia de COVID-19. 9 de ellos relación con efectos adversos. 9 estudios con población general vs 7 estudios con hipertensos. |
El uso de IECAS/BRAs (en 27 % de población general) no fue asociado al riesgo incrementado de morbilidad por COVID-19 en aquellos pacientes sin hipertensión después de realizar un modelo ajustado por hipertensión usando meta-regresión o regresión meta (ORa/coeficiente = 1,00, 95 % IC: 1,00-1,00; p=0,660). Al contrario, en pacientes hipertensos que usaron IECAS/BRAs (41 % de la población total) no se produjo incremento de riesgo de severidad por enfermedad COVID-19 (OR= 0,90, 95 % IC: 0,55-1,47; p=0,664; I2=98,0 %) o mortalidad (OR= 01,43, 95 % IC: 0,97-2,10; p=0,070) en aquellos pacientes con COVID-19. Esto sugiere que el riesgo real para incrementar la severidad de COVID-19 es la hipertensión. Este estudio sugiere no discontinuar el uso de IECAS/BRAs durante la pandemia de COVID-19. “La hipertensión asociada a un grado leve de inflamación mediada por interleucinas o citoquinas y el desbalance inmunológico puede afectar la circulación pulmonar y reducir el efecto de la barrera inmunológica e incrementar el riesgo de infección pulmonar”. Además, se ha observado que los hipertensos son más susceptibles a la enfermedad por SARS-Cov-19 en comparación con la población general. El uso de IECAS/BRAs en hipertensos con COVID-19 reduce el riesgo soporte avanzado de vida en aquellos con enfermedad grave, al disminuir de manera efectiva el SRAA. Adicionalmente, la “Angio II produce vasoconstricción pulmonar, acelera la formación de fibrosis pulmonar, promueve la inflamación y aumenta el estrés oxidativo”. Se ha determinado que los efectos adversos de la Angiotensina II son inhibidos al inducir la expresión de la ECA 2 pulmonar con IECAS/BRAs. BRAs protege del daño pulmonar al bloquear los receptores AT1. |
Todos los estudios fueron observacionales. Como todo estudio metaanálisis, los sesgos de selección son comunas en estudios retrospectivos derivados de récords médicos, por otro lado por la estricta clasificación de los casos COVID-19 sustentados por RT-PCR positivos al inicio de la pandemia. |
|
Lukito, et al.(45) |
Estudio prospectivo no randomizado, nivel abierto. |
75 pacientes |
Grupo 1 (35 pacientes) terapéutica estándar con Candesartán 4- 32 mg cada día por 10 días basado en PAS Grupo 2 (40 pacientes) terapéutica estándar. |
Un total de 89,3 % de los pacientes tenían SARS-Cov-2 Moderado y 10,6 % tenían COVID-19 severo. Ninguno de los pacientes requirió UCIs. Candersartán redujo la estancia hospitalaria de manera significante en relación al otro grupo (HRa= 1,74, 95 % IC: 1,01-2,97), después de ajustar por factores de confusión como edad, genero, hipertensión y diabetes (DMT2), no redujeron el tiempo de negatividad de la prueba de hisopado (HRa= 1,55, 95 % IC: 0,92-2,63). En el grupo de Candersartán, cuando se realizó un ajuste para los factores de confusión, fue asociado a un tiempo acortado de hospitalización (HRa= 3,07, 95 % IC: 1,33-7,12). Este estudio no encontró diferencias significativas en el radio de neutrófilos-linfocitos y la proteína C reactiva. Además, demostró seguridad farmacológica, sin presencia de efectos colaterales en cada uno de los grupos. Candersartán, es un antagonista AT1 que inhibe la ECA-Ang II- AT1 en el SRAA. Candersartán protege del daño potencial del pulmón inducido por COVID-19. Además, tiene un efecto protector conta la fibrosis pulmonar a través de mecanismos moleculares el que incluye la regulación del crecimiento del factor β1. ECA 2 bioquímicamente reduce la expresión de la IL 6 transformando la Ang II en Ang 1-7, como función oxidativa, lo que permite que incremente el nivel de líquido surfactante y permitiendo la vasodilatación sistémica. Adicionalmente el uso de Candersartán, disminuye la concentración de linfocitos T CD3 y CD8 disminuyendo de manera indirecta la carga viral, comparado con otros antihipertensivos que no tienen esa propiedad. Los biomarcadores serológicos de inflamación como la IL. Interferón gamma, factor de necrosis tumoral alfa y la PCR están directamente asociados con el pronóstico de pacientes con COVID-19. Los cuales permanecen muy alterados en pacientes incluso con alteración moderada de SARS-Cov-2. |
No se incluyeron pacientes obesos en el estudio. El poder estadístico y la muestra son muy pequeños como para observar significativamente los efectos entre los dos grupos de estudio. Diseño abierto no blindado el cual no es adecuado para un estudio experimental controlado. La muestra del estudio pudo haber pasado por sesgo de selección. |
|
Zekavat et al.(43) |
Cohorte Prospectivo. Población nacional. Randomización Mendeliana relacionada a la presión arterial con neumonía. |
377 143 participante s de Inglaterra (UK) |
Hipertensos con enfermedad respiratoria aguda severa durante el seguimiento. |
“La prevalencia de hipertensión fue asociada con el riesgo independiente e incrementado de producir neumonía (HR= 1,36, 95 % IC: 1,29-1,43), así como, otras infecciones respiratorias agudas bajas y fallo respiratorio”. “Randomización Mendeliana demostró una relación causal entre incremento de la presión arterial y el aumento del riesgo de neumonía”. Además, sugiere que el incremento crónico de Ang II activa los linfocitos T y la infiltración perivascular de adipocitos (células grasas). Sugiere además que los monocitos y linfocitos están asociados al incremento de la Ang II en la hipertensión y la disfunción vascular. Por otro lado, un estudio similar con Randomización Mendeliana citado en este artículo también demostró la relación entre presión de sangre y la alteración de neutrófilos, monocitos y eosinófilos.(60) |
El estudio fue realizado solo a participantes blancos de Inglaterra, por lo tanto, los resultados no son generalizable para otros grupos étnicos de otras regiones. Este estudio emplea un instrumento genético debido a la exposición por COVID 19 y no se ajustó para un solo gen para dos o más diferentes efectos (pleiotropía). El diseño de modelo ajustado en la muestra única del análisis Randomización Mendeliana para reducir el sesgo de colisionador es insuficiente. Los análisis de Randomización Mendeliana aleatoria proporcionan resultados consistentes sin evidencia de efectos (pleiotropía), heterogeneidad y variantes individuales que demuestren la asociación estadística. |
|
Baral et al.(61) |
Meta-análisis |
Datos clínicos fueron extraídos de 52 estudios elegibles (40 estudios cohortes, 6 series de casos, 4 caso- control, 1 estudio randomizado y 1 estudio cross seccional |
IECAS/ BRAs vs otros antihipertensivos/ sin IECAS/ BRAs |
Cuando se realizó el análisis agrupado por factores de confusión entre 17 estudios (un total de 17 392 participantes) usando un modelo ajustado para mortalidad se observó una reducción significativa de riesgo de mortalidad en aquellos pacientes que usaban IECAS/ BRAs vs otros antihipertensivos/ sin IECAS/ BRAs (ORa= 0,57, 95 % IC: 0,43-0,76; p<0,001; I2=54,0 %). Este estudio fue consistente con otro estudio metaanálisis.(51) En cuanto a la seguridad del tratamiento antihipertensivo: un total de 23 estudios (23 129 participantes de 48 estudios [total 98 985 participantes]) tuvieron un riesgo ajustado disminuido de efecto adverso severo por el uso de IECAS/ BRAs en el metaanálisis (ORa= 0,68, 95 % IC: 0,53-0,88; p=0,003; I2=67,0 %). |
Insuficientes datos y la inconsistencia entre los diversos diseños de estudios y datos de medicales récords disminuyen la calidad de evidencia científica en el estudio, además, no permite la comparación de los estudios con un grupo control. El estudio demuestra un moderada nivel de heterogeneidad es cual es usual entre estudios de diversas características entre las regiones continentales diversas. El estudio no definió criterios para el uso crónico de IECAS/ BRAs. |
|
Amat- Santos, et al.(62) |
Estudio clínico randomizado llamado RASTAVI (Renin-Angiotensin System Blockade Benefits in Clinical Evolution and Ventricular Remodeling After Transcatheter Aortic Valve Implantation) |
Incluye 14 centros hospitalario s de España. 102 pacientes, de los cuales 50 estuvieron en el grupo de ramipril y 52 en el grupo control. |
El tiempo promedio (media) de tratamiento fue 6 meses sea para ramipril o placebo.11 pacientes (10,8 %) tuvieron síntomas de COVID-19, con prueba positiva de RT-PCR, de los cuales 5 de ellos emplearon ramipril y 6 se los asignó al grupo control. |
El riesgo elevado de COVID-19 se observó en pacientes ancianos (mediana de 86 a/e vs 83 86 a/e, respectivamente) (p=0,019), con fibrilación atrial/anemia (p=0,066), hematocrito disminuido (p=0,084) y con más comorbilidades (p=0,065). Los pacientes randomizados al grupo de ramipril no tuvieron impacto en el incremento de incidencia o severidad por SARS-Cov-2. No se observó diferencias entre pacientes con factores de riesgo cardiovascular (incluye HTA, DMT2, Dislipidemia) con o sin COVID-19. Globalmente, no hubo diferencias entre pacientes con comorbilidades complejas, así como enfermedad coronaria, EPOC severa o moderada y enfermedad renal crónica. 4 de 5 pacientes hospitalizados con SARS-Cov-2 murieron por distrés respiratorio agudo, pero ninguna diferencia fue encontrada de acuerdo al grupo asignado, 2 de ellos que usaron inhibidores de SRAA o 2 que usaron cuidados estándar, estos 4 pacientes presentaron falla cardiaca a pesar del tratamiento exitoso de sus enfermedades valvulares cardiacas. Este estudio demostró que solo la hipertensión es un riesgo significativo de desarrollar COVID-19. El uso de inhibidores de SRAA no están asociados con incremento de riesgo de padecer la infección por COVID-19, ni severidad ni mortalidad por SARS-Cov-2. “Por otro lado ECA2 es consideradamente similar a ECA, el cual convierte Ang I en Ang II, por lo tanto, no ECA 2, es el objetivo de los IECAs”. A pesar de las evidencias contradictorias, este estudio experimental sugiere que la regulación positiva de citoquinas inflamatorias causada por Ang II, el cual se consideraba peligrosa en pacientes con COVID-19, puede ser reducida por la reducida formación de angiotensina II causada por inhibidores de SRAA. Cuando los IECAS son usados, estos previenen la conversión de Ang I en Ang II. Mientras que los BRAs actúan sobre el receptor de la Ang II (AT1R). Cuando una desintegrina y metaloproteasa 17 (ADAM17) se une a ECA 2 da como producto la ECA 2 soluble que puede prevenir la entrada del COVID-19 a la célula. |
La naturaleza retrospectiva, el número pequeño de casos confirmados de infección por COVID-19, el seguimiento de los pacientes realizado en corto periodo de tiempo y la falta de detección de inmunización de los pacientes, fueron las principales limitantes de este estudio. |
Los inhibidores del SRAA incrementan la expresión de la ECA 2, evitan la reducción de la producción de ACE 2 pulmonar inducido por la infección pulmonar, ya sea por internalización viral intracelular o la desregulación de la enzima ACE 2 durante el proceso asociado a la disminución de la secreción de citoquinas que tienen un efecto inflamatorio a nivel pulmonar, causando un efecto protector.(28,57,77,78,79,80) En pacientes con terapias IECAS/ BRAs que tuvieron >50 % de infiltrado pulmonar fueron menos que aquellos grupos con otros antihipertensivos, p=0,020.(26,50) Se ha determinado que los efectos adversos de la Angiotensina II son inhibidos al inducir la expresión de la ECA 2 pulmonar con IECAS/BRAs. BRAs protege del daño pulmonar al bloquear los receptores AT1.(59)
En el estudio “La hipertensión asociada a un grado leve de inflamación mediada por interleucinas o citoquinas y el desbalance inmunológico puede afectar la circulación pulmonar y reducir el efecto de la barrera inmunológica e incrementar el riesgo de infección pulmonar”. Además, se ha observado que los hipertensos son más susceptibles a la enfermedad por SARS-Cov-19 en comparación con la población general. El uso de IECAS/BRAs en hipertensos con COVID-19 reduce el riesgo soporte avanzado de vida en aquellos con enfermedad grave, al disminuir de manera efectiva el SRAA. La “Angio II produce vasoconstricción pulmonar, acelera la formación de fibrosis pulmonar, promueve la inflamación y aumenta el estrés oxidativo”.(59)
Lukito, et al.(45) refiere que ECA 2 bioquímicamente reduce la expresión de la IL 6 transformando la Ang II en Ang 1-7, como función oxidativa, lo que permite que incremente el nivel de líquido surfactante y permitiendo la vasodilatación sistémica. Adicionalmente el uso de Candersartán, disminuye la concentración de linfocitos T CD3 y CD 8 disminuyendo de manera indirecta la carga viral, comparado con otros antihipertensivos que no tienen esa propiedad.(45)
Adicionalmente, los pacientes con enfermedades obstructivas crónicas (EPOC) que toman BRAs tienen menor riesgo de severidad y mortalidad por EPOC.(47) Los IECAs/ARA II o BRAs están asociados al mejoramiento de la neumonía por COVID- 19.(48) Los IECAS/ BRAs fueron asociados con más casos de altas médicas.(53)
Dos estudios experimentales los pacientes randomizados al grupo de ramipril o inhibidores del SRAA no tuvieron impacto en el incremento de incidencia o severidad por SARS-Cov-2.(62,81) No se observó diferencias entre pacientes con factores de riesgo cardiovascular (incluye HTA, DMT2, Dislipidemia) con o sin COVID-19.(62) Globalmente, no hubo diferencias entre pacientes con comorbilidades complejas, así como enfermedad coronaria, EPOC severa o moderada y enfermedad renal crónica.(62)
Además, se evidencio que los IECAs/ARA II o BRAs no están asociados con la alta incidencia de infección por COVID-19.(48)
Otros estudios también demostraron que ninguna de las medicaciones antihipertensivas (IECAS/ BRAs, BCCs, β bloqueantes) fueron asociadas con incremento del riesgo de severidad(18,50,82) y muerte por SARS-Cov-2,(18,82) Los pacientes que tomaron inhibidores de SRAA tuvieron 35 % menos posibilidad de morir o menos riesgo de mortalidad por COVID-19 que aquellos que no tomaban IECAS/ BRAs durante la hospitalización, p<0,01.(5)
Once estudios de metaanálisis, también refirieron cuando se agruparon los estudios por tipos de antihipertensivos IECAS y/o BRAs, o analizados independientemente, no fueron asociados al riesgo incrementado de infección y progreso o severidad de la enfermedad por COVID-19,(33,51,54,55,59,83,84,85,86,87,88) larga estadía hospitalaria(84) o mortalidad por COVID-19(33,83,85,88) en su lugar tienen un efecto protector en pacientes hipertensos.(51,89) Así como hospitalización(55) o admisión a UCIs por requerimiento de ventilación mecánica.(51,55) Dos metaanálisis diseñados por Baral et al.(61) y Hasan et al.(90) observaron una reducción significativa de riesgo de mortalidad en aquellos pacientes que usaban IECAS/ BRAs vs otros antihipertensivos/ sin IECAS/ BRAs, p<0,001.(59,61,62,89,90) Esto sugiere que el riesgo real para incrementar la severidad de COVID-19 es la hipertensión.(59,62) Zekavat et al.(43) sugiere que “La prevalencia de hipertensión fue asociada con el riesgo independiente e incrementado de producir neumonía, así como, otras infecciones respiratorias agudas bajas y fallo respiratorio”. Además, sugiere que el incremento crónico de Ang II activa los linfocitos T y la infiltración perivascular de adipocitos (células grasas). Sugiere además que los monocitos y linfocitos están asociados al incremento de la Ang II en la hipertensión y la disfunción vascular.(43) Por otro lado, las trampas extracelulares de neutrófilos pueden potencialmente propagar la inflamación y trombosis microvascular, especialmente en situación de síndrome de distrés respiratorio agudo, asociado a neutrofilia (aumento de neutrófilos serológicos) como indicador de peor pronóstico de COVID-19.(91,92)
Controversialmente, pocos estudios demostraron en su análisis ajustado que los casos severos o muerte por SARS-Cov-2 ocurrieron en aquellos que usaron IECAS/BRAs que en aquellos que no lo usaron IECAS/BRAs.(58) Un estudio de metaanálisis en el 2020 demostró que el uso de BRAs y no así en IECAS, puede incrementar el riesgo de infección de COVID-19 en personas menores de 60 años.(67) Los autores sugieren que los IECAS y ARA II son responsables de incrementar los ACEII (alta expresión de ACE a nivel endotelial y pulmonar), receptores celulares que permiten la adherencia e infiltración del COVID-19 a la célula.(24)
Controversialmente, algunos estudios sugieren que el uso de inhibidores del SRAA incrementan la susceptibilidad del virus al incrementar la expresión de ECA 2, como receptor del COVID-19 para el ingreso a la célula humana,(20,56,58) afectando la susceptibilidad de SARS-Cov-2. Mientras que estudios independientes sugieren un potencial daño en el uso de inhibidores del SRAA, y porque no existe suficiente evidencia de los beneficios que poseen los IECAS/ BRAs durante la terapia de COVID-19.(93) Por otro lado, los inhibidores del SRAA están asociados con el incremento del riesgo de daño renal agudo.(93) Nouri-Vaskeh et al.(24) no demostraron una asociación entre la administración de losartán o amlodipina en la reducción del riesgo de mortalidad o severidad en pacientes con COVID-19. Wang et al.(53) [estudio cohorte retrospectiva] refirió que no existe diferencias significativas entre los grupos de antihipertensivos IECAS/ BRAs vs antihipertensivos no IECAS/BRAs o complicaciones clínicas tales como fluctuaciones de la PD (presión diastólica), el radio de supervivencia acumulada, días de estancia en UCI, o severidad de la enfermedad por COVID-19.
Se esclareció que el efecto es potencialmente diferente en el riesgo de severidad de COVID-19, por su mecanismo farmacológico diferente en el SRAA, por lo cual se observó una modesta posibilidad de test positivo para COVID-19 en aquellos que usaron β bloqueantes.(18) Adicionalmente, el alto riesgo de desarrollar severidad de la enfermedad por COVID-19 se debe al polimorfismo de la ECA.(37,73) Este polimorfismo del ECA es más común entre los caucásicos y asiáticos, así como en niños.(38) Por otro lado, la reducción del efecto protector de la ECA a nivel de pulmón puede desencadenar en el mayor componente de patogenicidad del COVID- 19.(94) Por tal motivo es importante incrementar la ECA 2 mediante los inhibidores del SRAA.(94)
Seguridad farmacológica de los inhibidores del SRAA en pacientes hipertensos durante la enfermedad grave por COVID-19. Nouri-Vaskeh et al.(24) refirieron que no se presentaron efectos adversos durante el tratamiento con Losartán y amlodipina, lo cual demuestran una apropiada seguridad de los fármacos. Un metaanálisis con 28 872 participantes demostró una alta seguridad del uso de IECAS y BRAs en pacientes hipertensos con COVID-19.(65) Estudios sugieren no discontinuar el uso de IECAS/BRAs durante la pandemia de COVID-19,(24,58,59,83,86,87,88,89,88) debido a sus resultados favorables en seroconversión o negativización de la prueba RT-PCR.(86) Demostró seguridad farmacológica, sin presencia de efectos colaterales en cada uno de los grupos (Candesartán vs terapéutica estándar).(45) Candersartán protege del daño potencial del pulmón inducido por COVID-19. Además, tiene un efecto protector conta la fibrosis pulmonar a través de mecanismos moleculares el que incluye la regulación del crecimiento del factor β1.(45) Lukito et al.(45) no encontró diferencias significativas en el radio de neutrófilos-linfocitos y la proteína C reactiva. Losartán y amlodipina demostraron una reacción significativa de mejoramiento de la saturación de oxígeno capilar (O2 %).(24,95,96,97)
Losartán hubo un descenso considerable de linfocitos T entre el inicio del estudio y la alta médica hospitalaria mientras que en la amlodipina no se observó similar efecto.(24,98,99)
En un análisis ajustado no se evidenció que exista un efecto peligroso adverso de los BRAs durante el tratamiento de COVID-19.(58) Este estudio sugiere una seguridad aceptable del uso de BRAs en pacientes con COVID e hipertensión arterial.(58) Mientras que, en cuanto a la seguridad del tratamiento antihipertensivo en un metaanálisis: un total de 23 estudios (23 129 participantes de 48 estudios [total 98 985 participantes]) tuvieron un riesgo ajustado disminuido de efecto adverso severo por el uso de IECAS/ BRAs.(61)
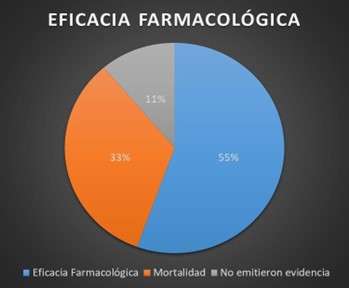
Figura 1. Eficacia Farmacológica
El 55 % de los estudios mostraron que había eficacia farmacológica en el uso de los IECAS/BRAS para pacientes hipertensos.
El 33 % de los estudios indicaron que no hubo mejoría al usar IECAS/BRAS en pacientes hipertensos, se reportaron mayormente gravedad, ingresos a salas UCI y muertes.
Un 11 % de los estudios no indicaron resultados, se entienden que no emitieron juicio sobre su es propicio usar o no IECAS/BRAS sobre pacientes hipertensos con SARS- CoV-2.
CONCLUSIONES
Los biomarcadores serológicos de inflamación como la IL, Interferón gamma, factor de necrosis tumoral alfa y la PCR están directamente asociados con el pronóstico de pacientes con COVID-19. Los cuales permanecen muy alterados en pacientes incluso con alteración moderada de SARS-Cov-2.
Cuando se comparó la eficacia farmacológica del uso de los IECAs y/o ARA II/ BRAs en pacientes hipertensos o sin hipertensión con insuficiencia respiratoria aguda por COVID-19, los IECAs y BRAs demostraron mejor eficacia en términos de disminución de la presión arterial, control de los procesos inflamatorios y bajo riesgo de severidad por COVID, con respecto al riesgo de mortalidad, éste fue menor en IECAs que en BRAs.
Cuando se comparó los efectos farmacológicos de los IECAs y ARA II o BRAs asociados a la reducción de la hipertensión, mortalidad y severidad de la infección por COVID-19, la mayoría de los estudios publicados demostraron que los IECAs y ARA II o BRAs fueron significativamente asociados (asociación positiva) con bajo riesgo de enfermarse gravemente/ hospitalizarse por SARS-Cov-2, bajo riesgo de entubación y mortalidad por insuficiencia respiratoria grave o neumonía grave o enfermedades cardiovasculares en comparación con otros antihipertensivos. Adicionalmente, los pacientes con enfermedades obstructivas crónicas (EPOC) que toman BRAs tienen menor riesgo de severidad y mortalidad por EPOC. Los IECAs y ARA II o BRAs están asociados al mejoramiento de la neumonía por COVID-19. Los IECAS/ BRAs fueron asociados con más casos de altas médicas. Esta evidencias fueron encontradas en la mayoría de los artículos científicos publicados mientras que una minoría de estudios observacionales, no metaanálisis, sugirieron lo contrario.
En la comunidad científica se sabe que un metaanálisis basado en ensayos clínicos controlados o estudios experimentales canonizados representan la más alta calidad de evidencia científica, sin embargo en la actualidad, julio 2021, muy pocos estudios randomizados se han publicado. La evidencia científica analizada en esta revisión sistemática fue de una calidad media-baja, por lo cual se sugiere una nueva revisión sistemática que implique un metaanálisis de estudios clínicos controlados o de doble ciego de alta calidad científica.
Cuando se analizó la seguridad farmacológica de los inhibidores del SRAA en pacientes hipertensos durante la enfermedad grave por COVID-19, un número de 8 estudios de 19 estudios ingresados en la revisión sistemática, sugieren no discontinuar el uso de IECAS/BRAs durante la pandemia de COVID-19. Mas del 50 % (n=5/8 estudios) de los estudios publicados demostraron seguridad farmacológica, sin presencia de efectos colaterales en cada uno de los grupos.
Limitaciones del estudio
A pesar de que se trató de realizar grupos homogéneos de comparación de pacientes tratados con antihipertensivos, algunos de ellos no estaban bien definidas sus comorbilidades cardiovasculares para definir claramente el riesgo de COVID-19. Se comparó jóvenes y adultos mayores con monoterapias antihipertensivas (segregándolos en 3 grupos) lo que ocasionó un impacto sobre la asociación del estudio. No todas las personas en este estudio fueron hospitalizadas ni tuvieron diagnóstico positivo de COVID-19 con RT-PCR, en su lugar se usó la codificación CIE-10, de alta especificidad, pero baja sensibilidad. Algunos de los pacientes tuvieron más de dos pruebas diagnósticas para COVID-19. Como efecto colateral de los IECAs: se evitó pacientes que estén tomando por largos periodos de tiempos IECAs debido a la intolerancia de la medicación. Por otro lado, los datos son datos secundarios colectados en un corto periodo de tiempo, por lo cual existe la posibilidad de sesgo de selección. Por ser datos secundarios, no se puede garantizar la toma apropiada de medicación antihipertensiva (todos los días), pero un análisis indirecto de la cantidad de semanas en tratamiento sugiere buena adherencia a los antihipertensivos en la mayoría de los pacientes. La naturaleza retrospectiva del estudio permite datos faltantes o no disponibles relacionados a la toma de medicación antihipertensiva intrahospitalaria o constancia de la toma de antihipertensivos. No fue confirmada la información del uso diario de la terapia antihipertensiva de manera cotidiana y prolongada y buena adherencia farmacológica. Sesgo de no clasificación debido a que la mayoría de los pacientes con enfermedad cardiovascular grave previa (infarto al miocardio) estaban altamente asociados con mortalidad por SARS-Cov-2. Este estudio no demostró casualidad o inferencia casual (por incluir mayormente estudios observacionales, por lo tanto, las relaciones son interpretadas como asociaciones). Por lo tanto, este estudio sugiere que debe haber una diferencia sustancial entre los pacientes manejados de manera domiciliaria o por consulta externa y aquellos hospitalizados por hipertensión, además ocurre de igual manera por grupo étnico y distribución geográfica diversa. Factores de confusión ingresados por la diferencia en proporción de pacientes que usaron β bloqueantes y diuréticos entre IECAS/ BRAs y el grupo sin IECAS/ BRAs. Algunos de los estudios observacionales, tuvieron un poder estadístico y muestra muy pequeños como para observar significativamente los efectos diferentes entre IECAS y BRAs. Un estudio de metaanálisis, incluyó sesgo de publicación, puesto que este estudio solo analizó pocas publicaciones de alto impacto lo cual influye sobre la calidad de la evidencia científica. Algunos estudios no analizaron los factores de confusión tales como sexo, edad, consumo de tabaco y diabetes en sus análisis estadísticos.
Líneas de investigación
Con los resultados de este estudio de revisión sistemática se sugiere estudios de ensayos clínicos randomizados con un alto poder estadístico dirigido a los pacientes con síndrome respiratorio agudo severo por coronavirus tipo 2 (SARS-Cov-2). Existe una urgente necesidad de elaborar un estudio similar en la población ecuatoriana a nivel hospitalario, o un estudio de cohorte prospectivo sobre la población afecta, que permitan evaluar la eficacia de los tratamientos antihipertensivos durante la enfermedad por COVID-19.
Aspectos relevantes
En la actualidad, a nivel global, se han publicado estudios observacionales y metaanálisis cuyo contenido científico se ha limitado a una calidad de evidencia científica media-baja, cuyas conclusiones o resultados no han permitido dilucidar la hipótesis sobre si los IECAs y/o BRAs están asociados positivamente en la reducción del riesgo de morbilidad, severidad, mortalidad por SARS-Cov-2 y complicaciones inherentes sujetas a la duración del tratamiento antihipertensivo. Sin embargo, la poca evidencia científica ha permitido crear criterios contrastados o controversiales que permite seguir juzgando la importancia de los antihipertensivos en la práctica médica clínica. Por otro lado, las conclusiones positivas sobre los beneficios adicionales del uso de los antihipertensivos abren una implicación de nuevos aportes científicos y la urgencia de nuevos fármacos antihipertensivos durante las pandemias virales.
REFERENCIAS BIBLIOGRÁFICAS
1. Salazar M, Barochiner J, Espeche W, Ennis I. COVID-19 and its relationship with hypertension and cardiovascular disease. Hipertens Riesgo Vasc. 2020;37(4):176-80.
2. Torjesen I. Covid-19: Doctors should be alert for signs of myocardial injury, says NICE. BMJ. 2020;369:m1639.
3. Tignanelli CJ, Ingraham NE, Sparks MA, Reilkoff R, Bezdicek T, Benson B, et al. Antihypertensive drugs and risk of COVID-19? Lancet Respir Med. 2020.;8(5):e30-1.
4. Ssentongo AE, Ssentongo P, Heilbrunn ES, Lekoubou A, Du P, Liao D, et al. Renin-angiotensin-aldosterone system inhibitors and the risk of mortality in patients with hypertension hospitalized for COVID-19: systematic review and meta-analysis. Open Heart. 2020;7(2):e001353.
5. Mancia G, Rea F, Ludergnani M, Apolone G, Corrao G. Renin-angiotensin-aldosterone system blockers and the risk of COVID-19. N Engl J Med. 2020;382(25):2431-40.
6. Kreutz R, Algharably EAE, Azizi M, Dobrowolski P, Guzik T, Januszewicz A, et al. Hypertension, the renin-angiotensin system, and the risk of lower respiratory tract infections and lung injury: implications for COVID-19. Cardiovasc Res. 2020;116(10):1688-99.
7. Yang J, Zheng Y, Gou X, Pu K, Chen Z, Guo Q, et al. Prevalence of comorbidities and its effects in coronavirus disease 2019 patients: A systematic review and meta-analysis. Int J Infect Dis. 2020;94:91-5.
8. Vuorio A, Watts GF, Kovanen PT. Familial hypercholesterolaemia and COVID-19: triggering of increased sustained cardiovascular risk. J Intern Med. 2020;288(4):456-8.
9. Vlachakis PK, Tentolouris A, Tousoulis D, Tentolouris N. Current data on the cardiovascular effects of the COVID-19. Hellenic J Cardiol. 2020;61(1):1-5.
10. Yang C, Jin Z. An acute respiratory infection runs into the most common noncommunicable epidemic-COVID-19 and cardiovascular diseases. JAMA Cardiol. 2020;5(7):723-5.
11. Yan T, Xiao R, Lin G. Angiotensin-converting enzyme 2 in severe acute respiratory syndrome coronavirus and SARS-CoV-2: A double-edged sword? FASEB J. 2020;34(5):6017-26.
12. Wynants L, Van Calster B, Bonten MMJ, Collins GS, Debray TPA, De Vos M, et al. Prediction models for diagnosis and prognosis of COVID-19 infection: systematic review and critical appraisal. BMJ. 2020;369:m1328.
13. Wood DA, Sathananthan J, Gin K, Mansour S, Ly HQ, Quraishi AU, et al. Precautions and procedures for coronary and structural cardiac interventions during the COVID-19 pandemic: Guidance from the Canadian Association of Interventional Cardiology. Can J Cardiol. 2020;36(6):780-3.
14. Wang T, Du Z, Zhu F, Cao Z, An Y, Gao Y, et al. Comorbidities and multi-organ injuries in the treatment of COVID-19. Lancet. 2020;395(10228):e52.
15. Henry D. Antihypertensive drugs and COVID-19. Heart. 2021;107(1):85.
16. Villa E, Saccocci M, Messina A, Maffeo D, Piti A, Bianchetti F, et al. COVID-19 y enfermedad coronaria: uso selectivo y colaborativo de recursos durante crisis de salud pública. G Ital Cardiol (Rome). 2020;21(5):360-3.
17. Reynolds HR, Adhikari S, Pulgarin C, Troxel AB, Iturrate E, Johnson SB, et al. Renin-angiotensin-aldosterone system inhibitors and risk of COVID-19. N Engl J Med. 2020;382(25):2441-8.
18. Zhou F, Yu T, Du R, Fan G, Liu Y, Liu Z, et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet. 2020;395(10229):1054-62.
19. Esler M, Esler D. Can angiotensin receptor-blocking drugs perhaps be harmful in the COVID-19 pandemic? J Hypertens. 2020;38(5):781-2.
20. Duvignaud A, Lhomme E, Pistone T, Onaisi R, Sitta R, Journot V, et al. Home treatment of older people with symptomatic SARS-CoV-2 infection (COVID-19): a structured summary of a study protocol for a multi-arm multi-stage randomized trial. Trials. 2020;21(1):846.
21. Molina DI, Munoz TM, Guevara K. Inhibidores de la enzima convertidora de angiotensina y bloqueadores de los receptores de angiotensina II: ¿aumentan el riesgo de padecer COVID-19? Rev Colomb Cardiol. 2020;27(3):132-6.
22. Cohen JB, Hanff TC, Corrales-Medina V, William P, Renna N, Rosado-Santander NR, et al. Randomized elimination and prolongation of ACE inhibitors and ARBs in coronavirus 2019 (REPLACE COVID) trial protocol. J Clin Hypertens (Greenwich). 2020;22(10):1780-8.
23. Nouri-Vaskeh M, Kalami N, Zand R, Soroureddin Z, Varshochi M, Ansarin K, et al. Comparison of losartan and amlodipine effects on the outcomes of patient with COVID-19 and primary hypertension: A randomized clinical trial. Int J Clin Pract. 2021;75(6):e14124.
24. Kuster GM, Pfister O, Burkard T, Zhou Q, Twerenbold R, Haaf P, et al. SARS-CoV-2: Should inhibitors of the renin-angiotensin system be withdrawn in patients with COVID-19? Eur Heart J. 2020;41(19):1801-3.
25. Bozkurt B, Kovacs R, Harrington B. Joint HFSA/ACC/AHA statement addresses concerns re: using RAAS antagonists in COVID-19. J Card Fail. 2020;26(5):370.
26. Shimels T, Asrat Kassu R, Bogale G, Bekele M, Getnet M, Getachew A, et al. Magnitude and associated factors of poor medication adherence among diabetic and hypertensive patients visiting public health facilities in Ethiopia during the COVID-19 pandemic. PLoS One. 2021;16(4):e0249222.
27. Muchtaridi M, Fauzi M, Khairul Ikram NK, Mohd Gazzali A, Wahab HA. Natural flavonoids as potential angiotensin-converting enzyme 2 inhibitors for anti-SARS-CoV-2. Molecules. 2020;25(17):3980.
28. Li W, Zhang C, Sui J, Kuhn JH, Moore MJ, Luo S, et al. Receptor and viral determinants of SARS-coronavirus adaptation to human ACE2. EMBO J. 2005;24(8):1634-43.
29. Hall JE, Guyton AC. Guyton y Hall. Tratado de fisiología médica. 13th ed. Barcelona: Elsevier; 2016. p. 227-43. ISBN: 978-84-9113-024-6.
30. Brunton LL, Chabner BA, Knollman BC. Las bases farmacológicas de la terapéutica. 12th ed. México DF: McGraw Hill; 2012. p. 721-88. ISBN: 978-0-07-162442-8.
31. Cabrera C. Sistema Renina Angiotensina Aldosterona. Ciudad Real: Hospital General Universitario de Ciudad Real (HGUCR); 2011 [cited 2025 Jan 17]. Available from: http://www.hgucr.es/wp-content/uploads/2011/12/eje_renina-angiotensina-aldosteromna.pdf..
32. Yokoyama Y, Aikawa T, Takagi H, Briasoulis A, Kuno T. Association of renin-angiotensin-aldosterone system inhibitors with mortality and testing positive of COVID-19: Meta-analysis. J Med Virol. 2021;93(4):2084-9.
33. Vaduganathan M, Vardeny O, Michel T, McMurray JJV, Pfeffer MA, Solomon SD. Renin-angiotensin-aldosterone system inhibitors in patients with Covid-19. N Engl J Med. 2020;382(17):1653-9.
34. Trifiro G, Crisafulli S, Ando G, Racagni G, Drago F; Italian Society of P. Should patients receiving ACE inhibitors or angiotensin receptor blockers be switched to other antihypertensive drugs to prevent or improve prognosis of novel coronavirus disease 2019 (COVID-19)? Drug Saf. 2020;43(6):529-32.
35. Pranata R, Permana H, Huang I, Lim MA, Soetedjo NN, Supriyadi R, et al. The use of renin-angiotensin system inhibitor on mortality in patients with coronavirus disease 2019 (COVID-19): A systematic review and meta-analysis. Diabetes Metab Syndr. 2020;14(5):983-90.
36. Hatami N, Ahi S, Sadeghinikoo A, Foroughian M, Javdani F, Kalani N, et al. Worldwide ACE (I/D) polymorphism may affect COVID-19 recovery rate: An ecological meta-regression. Endocrine. 2020;68(3):479-84.
37. Li L, Spranger L, Soll D, Beer F, Brachs M, Spranger J, et al. Metabolic impact of weight loss-induced reduction of adipose ACE-2: Potential implication in COVID-19 infections? Metabolism. 2020;113:154401.
38. Durán C, Marchand B, Jaramillo P, Herteleer J, Andrade A, Cevallos G, et al. Vademécum Farmacoterapeútico del Ecuador. 1st ed. Quito: Empresa Pública Yachay; 2015. p. 8.
39. Thiele H. Cardiovascular emergencies in the COVID-19 pandemic. Herz. 2020;45(4):345-50.
40. Tavazzi G, Pellegrini C, Maurelli M, Belliato M, Sciutti F, Bottazzi A, et al. Myocardial localization of coronavirus in COVID-19 cardiogenic shock. Eur J Heart Fail. 2020;22(5):911-5.
41. Zuin M, Rigatelli G, Zuliani G, Rigatelli A, Mazza A, Roncon L. Arterial hypertension and risk of death in patients with COVID-19 infection: Systematic review and meta-analysis. J Infect. 2020;81(1):e84-e6.
42. Zekavat SM, Honigberg M, Pirruccello JP, et al. Elevated blood pressure increases pneumonia risk: Epidemiological association and Mendelian randomization in the UK Biobank. Med. 2020;2(2):137-48.
43. Zhu H, Rhee JW, Cheng P, Waliany S, Chang A, Witteles RM, et al. Cardiovascular complications in patients with COVID-19: Consequences of viral toxicities and host immune response. Curr Cardiol Rep. 2020;22(5):32.
44. Lukito A, et al. Candesartan as a tentative treatment for COVID-19: A prospective non-randomized open-label study. Int J Infect Dis. 2021;108:159-66.
45. Hoffmann M, Kleine-Weber H, Schroeder S, et al. SARS-CoV-2 cell entry depends on ACE2 and TMPRSS2 and is blocked by a clinically proven protease inhibitor. Cell. 2020;181(2):271-80.e8.
46. Zhang P, Zhu L, Cai J, Lei F, Qin JJ, Xie J, et al. Association of inpatient use of angiotensin-converting enzyme inhibitors and angiotensin II receptor blockers with mortality among patients with hypertension hospitalized with COVID-19. Circ Res. 2020;126(12):1671-81.
47. Fosbøl EL, Butt JH, Østergaard L, Andersson C, Selmer C, Kragholm K, et al. Association of angiotensin-converting enzyme inhibitor or angiotensin receptor blocker use with COVID-19 diagnosis and mortality. JAMA. 2020;324(2):168-77.
48. Lu IN, Kulkarni S, Fisk M, Kostapanos M, Banham-Hall E, Kadyan S, et al. muLTi-Arm Therapeutic study in pre-ICu patients admitted with COVID-19-Experimental drugs and mechanisms (TACTIC-E): A structured summary of a study protocol for a randomized controlled trial. Trials. 2020;21(1):690.
49. Abdullah M, Khan K, Javed M, Iqbal J, Waheed K, Akhtar MN, et al. A comparison of disease severity and outcomes in COVID-19 cases taking angiotensin-converting enzyme inhibitors/angiotensin receptor blockers versus other antihypertensive drugs. Cureus. 2021;13(1):e12757.
50. Barochiner J, Martínez R. Use of inhibitors of the renin-angiotensin system in hypertensive patients and COVID-19 severity: A systematic review and meta-analysis. J Clin Pharm Ther. 2020;45(6):1244-52.
51. Semenzato L, Botton J, Drouin J, Baricault B, Vabre C, Cuenot F, et al. Antihypertensive drugs and COVID-19 risk: A cohort study of 2 million hypertensive patients. Hypertension. 2021;77(3):833-42.
52. Wang Z, Zhang D, Wang S, Jin Y, Huan J, Wu Y, et al. A retrospective study from 2 centers in China on the effects of continued use of angiotensin-converting enzyme inhibitors and angiotensin II receptor blockers in patients with hypertension and COVID-19. Med Sci Monit. 2020;26:e926651.
53. Zhang X, Yu J, Pan LY, Jiang HY. ACEI/ARB use and risk of infection or severity or mortality of COVID-19: A systematic review and meta-analysis. Pharmacol Res. 2020;158:104927.
54. Ren L, Yu S, Xu W, Overton JL, Chiamvimonvat N, Thai PN. Lack of association of antihypertensive drugs with the risk and severity of COVID-19: A meta-analysis. J Cardiol. 2021;77(5):482-91.
55. Diaz JH. Hypothesis: Angiotensin-converting enzyme inhibitors and angiotensin receptor blockers may increase the risk of severe COVID-19. J Travel Med. 2020;27(3):taaa044.
56. Henry C, Zaizafoun M, Stock E, Ghamande S, Arroliga AC, White HD. Impact of angiotensin-converting enzyme inhibitors and statins on viral pneumonia. Baylor Univ Med Cent Proc. 2018;31(4):419-23.
57. Kerneis M, Ferrante A, Guedeney P, Vicaut E, Montalescot G. Severe acute respiratory syndrome coronavirus 2 and renin-angiotensin system blockers: A review and pooled analysis. Arch Cardiovasc Dis. 2020;113(11):779-88.
58. Ma Z, Wang MP, Liu L, Yu S, Wu TR, Zhao L, et al. Does taking an angiotensin inhibitor increase the risk for COVID-19? A systematic review and meta-analysis. Aging (Albany NY). 2021;13(8):10853-65.
59. Davies NM, Holmes MV, Davey Smith G. Reading Mendelian randomisation studies: A guide, glossary, and checklist for clinicians. BMJ. 2018;362:k601.
60. Baral R, Tsampasian V, Debski M, Moran B, Garg P, Clark A, et al. Association between renin-angiotensin-aldosterone system inhibitors and clinical outcomes in patients with COVID-19: A systematic review and meta-analysis. JAMA Netw Open. 2021;4(3):e213594
61. Amat-Santos IJ, Santos-Martinez S, López-Otero D, Nombela-Franco L, Gutiérrez-Ibanes E, Del Valle R, et al. Ramipril in high-risk patients with COVID-19. J Am Coll Cardiol. 2020;76(3):268-76.
62. Xue Y, Sun S, Cai J, Zeng L, Wang S, Wang S, et al. Effects of ACEI and ARB on COVID-19 patients: A meta-analysis. J Renin Angiotensin Aldosterone Syst. 2020;21(4):1470320320981321.
63. Pirola CJ, Sookoian S. Estimation of renin-angiotensin-aldosterone-system (RAAS)-inhibitor effect on COVID-19 outcome: A meta-analysis. J Infect. 2020;81(2):276-81.
64. Baral R, White M, Vassiliou VS. Effect of renin-angiotensin-aldosterone system inhibitors in patients with COVID-19: A systematic review and meta-analysis of 28,872 patients. Curr Atheroscler Rep. 2020;22(10):61.
65. Chu C, Zeng S, Hasan AA, Hocher CF, Krämer BK, Hocher B. Comparison of infection risks and clinical outcomes in patients with and without SARS-CoV-2 lung infection under renin-angiotensin-aldosterone system blockade: Systematic review and meta-analysis. Br J Clin Pharmacol. 2021;87(6):2475-92.
66. Chan CK, Huang YS, Liao HW, Tsai IJ, Sun CY, Pan HC, et al. Renin-angiotensin-aldosterone system inhibitors and risks of severe acute respiratory syndrome coronavirus 2 infection: A systematic review and meta-analysis. Hypertension. 2020;76(5):1563-71.
67. Kow CS, Ming LC, Hasan SS. Renin-angiotensin system inhibitor use and the risk of mortality in hospitalized patients with COVID-19: A meta-analysis of randomized controlled trials. Hypertens Res. 2021;44(8):1042-5.
68. Biswas M, Kali MSK. Association of angiotensin-converting enzyme inhibitors and angiotensin-receptor blockers with risk of mortality, severity or SARS-CoV-2 test positivity in COVID-19 patients: Meta-analysis. Sci Rep. 2021;11(1):5012.
69. Lopes RD, Macedo AVS, de Barros ESPGM, Moll-Bernardes RJ, Dos Santos TM, Mazza L, et al. Effect of discontinuing vs continuing angiotensin-converting enzyme inhibitors and angiotensin II receptor blockers on days alive and out of the hospital in patients admitted with COVID-19: A randomized clinical trial. JAMA. 2021;325(3):254-64.
70. Flacco ME, Acuti Martellucci C, Bravi F, Parruti G, Cappadona R, Mascitelli A, et al. Treatment with ACE inhibitors or ARBs and risk of severe/lethal COVID-19: A meta-analysis. Heart. 2020;106(19):1519-24.
71. Kurdi A, Abutheraa N, Akil L, Godman B. A systematic review and meta-analysis of the use of renin-angiotensin system drugs and COVID-19 clinical outcomes: What is the evidence so far? Pharmacol Res Perspect. 2020;8(6):e00666.
72. Grover A, Oberoi M. A systematic review and meta-analysis to evaluate the clinical outcomes in COVID-19 patients on angiotensin-converting enzyme inhibitors or angiotensin receptor blockers. Eur Heart J Cardiovasc Pharmacother. 2021;7(2):148-57.
73. Patoulias D, Katsimardou A, Stavropoulos K, Imprialos K, Kalogirou MS, Doumas M. Renin-angiotensin system inhibitors and COVID-19: A systematic review and meta-analysis. Evidence for significant geographical disparities. Curr Hypertens Rep. 2020;22(11):90.
74. Cohen JB, Hanff TC, William P, Sweitzer N, Rosado-Santander NR, Medina C, et al. Continuation versus discontinuation of renin-angiotensin system inhibitors in patients admitted to hospital with COVID-19: A prospective, randomized, open-label trial. Lancet Respir Med. 2021;9(3):275-84.
75. Kerneis M, Ferrante A, Guedeney P, Vicaut E, Montalescot G. Severe acute respiratory syndrome coronavirus 2 and renin-angiotensin system blockers: A review and pooled analysis. Arch Cardiovasc Dis. 2020;113(12):797-810.
76. Verdecchia P, Reboldi G, Cavallini C, Mazzotta G, Angeli F. ACE-inhibitors, angiotensin receptor blockers and severe acute respiratory syndrome caused by coronavirus. G Ital Cardiol (Rome). 2020;21(5):321-7.
77. Varga Z, Flammer AJ, Steiger P, Haberecker M, Andermatt R, Zinkernagel AS, et al. Endothelial cell infection and endotheliitis in COVID-19. Lancet. 2020;395(10234):1417-8.
78. Cheng H, Wang Y, Wang GQ. Organ-protective effect of angiotensin-converting enzyme 2 and its effect on the prognosis of COVID-19. J Med Virol. 2020;92(7):726-30.
79. Usman MS, Siddiqi TJ, Khan MS, Ahmed A, Ali SS, Michos ED, et al. A meta-analysis of the relationship between renin-angiotensin-aldosterone system inhibitors and COVID-19. Am J Cardiol. 2020;130:159-61.
80. Bauer A, Schreinlechner M, Sappler N, Dolejsi T, Tilg H, Aulinger BA, et al. Discontinuation versus continuation of renin-angiotensin-system inhibitors in COVID-19 (ACEI-COVID): A prospective, parallel group, randomized, controlled, open-label trial. Lancet Respir Med. 2021;9(8):863-72.
81. Qiu R, Li J, Xiao Y, Gao Z, Weng Y, Zhang Q, et al. The therapeutic effect and safety of the drugs for COVID-19: A systematic review and meta-analysis. Medicine (Baltimore). 2021;100(16):e25532.
82. Xu J, Teng Y, Shang L, Gu X, Fan G, Chen Y, et al. The effect of prior angiotensin-converting enzyme inhibitor and angiotensin receptor blocker treatment on coronavirus disease 2019 (COVID-19) susceptibility and outcome: A systematic review and meta-analysis. Clin Infect Dis. 2021;72(11):e901-13.
83. Zhang G, Wu Y, Xu R, Du X. Effects of renin-angiotensin-aldosterone system inhibitors on disease severity and mortality in patients with COVID-19: A meta-analysis. J Med Virol. 2021;93(4):2287-300.
84. Koshy AN, Murphy AC, Farouque O, Ramchand J, Burrell LM, Yudi MB. Renin-angiotensin system inhibition and risk of infection and mortality in COVID-19: A systematic review and meta-analysis. Intern Med J. 2020;50(12):1468-74.
85. Sattar Y, Mukuntharaj P, Zghouzi M, Suleiman AM, Attique H, Ullah W, et al. Safety and efficacy of renin-angiotensin-aldosterone system inhibitors in COVID-19 population. High Blood Press Cardiovasc Prev. 2021;28(4):405-16.
86. Greco A, Buccheri S, D’Arrigo P, Calderone D, Agnello F, Monte M, et al. Outcomes of renin-angiotensin-aldosterone system blockers in patients with COVID-19: A systematic review and meta-analysis. Eur Heart J Cardiovasc Pharmacother. 2020;6(5):335-7.
87. Lee HW, Yoon CH, Jang EJ, Lee CH. Renin-angiotensin system blocker and outcomes of COVID-19: A systematic review and meta-analysis. Thorax. 2021;76(5):479-86.
88. Bezabih YM, Bezabih A, Alamneh E, Peterson GM, Bezabhe W. Comparison of renin-angiotensin-aldosterone system inhibitors with other antihypertensives in association with coronavirus disease-19 clinical outcomes. BMC Infect Dis. 2021;21(1):527.
89. Hasan SS, Kow CS, Hadi MA, Zaidi STR, Merchant HA. Mortality and disease severity among COVID-19 patients receiving renin-angiotensin system inhibitors: A systematic review and meta-analysis. Am J Cardiovasc Drugs. 2020;20(6):571-90.
90. Zuo Y, Yalavarthi S, Shi H, Gockman K, Zuo M, Madison JA, et al. Neutrophil extracellular traps in COVID-19. JCI Insight. 2020;5(11):e138999.
91. Zuckier LS, Moadel RM, Haramati LB, Freeman L. Diagnostic evaluation of pulmonary embolism during the COVID-19 pandemic. J Nucl Med. 2020;61(5):630-5.
92. Lee SA, Park R, Yang JH, Min IK, Park JT, Han SH, et al. Increased risk of acute kidney injury in coronavirus disease patients with renin-angiotensin-aldosterone-system blockade use: A systematic review and meta-analysis. Sci Rep. 2021;11(1):13588.
93. Kaur U, Acharya K, Mondal R, Singh A, Saso L, Chakrabarti S, et al. Should ACE2 be given a chance in COVID-19 therapeutics: A semi-systematic review of strategies enhancing ACE2. Eur J Pharmacol. 2020;887:173545.
94. Roldán J. Farmacovigilancia: datos sobre el estado actual de esta disciplina en Chile. Rev Med Clin Las Condes. 2016;27(5):585-93.
95. Hernández M, Tribiño G, Bustamante C. Caracterización de las potenciales interacciones farmacológicas en pacientes de una unidad de cuidados intensivos en un hospital de tercer nivel de Bogotá. Biomédica. 2018;38(3):407-16.
96. Bai L, Dai H, Xu Q, Junaid M, Peng S, Zhu X, et al. Prediction of effective drug combinations by an improved naïve Bayesian algorithm. Int J Mol Sci. 2018;19(2):467.
97. Cui Z, Gao Y, Liu J, Wang J, Shang J, Dai L. La predicción computacional de interacciones fármaco-enfermedad utilizando el método L2,1-CMF de red dual. BMC Bioinformatics. 2019;20(1):5.
98. Zhou YH, Qin YY, Lu YQ, Sun F, Yang S, Harypursat V, et al. Effectiveness of glucocorticoid therapy in patients with severe novel coronavirus pneumonia: Protocol of a randomized controlled trial. Chin Med J (Engl). 2020;133(9):1080-6.
99. Ye XT, Luo YL, Xia SC, Sun QF, Ding JG, Zhou Y, et al. Clinical efficacy of lopinavir/ritonavir in the treatment of Coronavirus disease 2019. Eur Rev Med Pharmacol Sci. 2020;24(6):3390-6.
FINANCIACIÓN
Ninguna.
CONFLICTO DE INTERÉS
Los autores declaran que no existe conflicto de interés.
CONTRIBUCIÓN DE AUTORÍA
Conceptualización: Franklin Francisco Castro Mindiola, Pilar Asunción Soledispa Cañarte.
Curación de datos: Franklin Francisco Castro Mindiola, Pilar Asunción Soledispa Cañarte.
Análisis formal: Franklin Francisco Castro Mindiola, Pilar Asunción Soledispa Cañarte.
Investigación: Franklin Francisco Castro Mindiola, Pilar Asunción Soledispa Cañarte.
Metodología: Franklin Francisco Castro Mindiola, Pilar Asunción Soledispa Cañarte.
Administración del proyecto: Franklin Francisco Castro Mindiola, Pilar Asunción Soledispa Cañarte.
Recursos: Franklin Francisco Castro Mindiola, Pilar Asunción Soledispa Cañarte.
Software: Franklin Francisco Castro Mindiola, Pilar Asunción Soledispa Cañarte.
Supervisión: Franklin Francisco Castro Mindiola, Pilar Asunción Soledispa Cañarte.
Validación: Franklin Francisco Castro Mindiola, Pilar Asunción Soledispa Cañarte.
Visualización: Franklin Francisco Castro Mindiola, Pilar Asunción Soledispa Cañarte.
Redacción – borrador original: Franklin Francisco Castro Mindiola, Pilar Asunción Soledispa Cañarte.
Redacción – revisión y edición: Franklin Francisco Castro Mindiola, Pilar Asunción Soledispa Cañarte.