doi: 10.56294/hl202288
ORIGINAL
Most commonly used treatment regimens for COVID-19 patients in the ICU and emergency room of the Hospital Teodoro Maldonado Carbo
Esquemas de tratamientos más utilizados para pacientes COVID-19 en UCI y emergencia del Hospital Teodoro Maldonado Carbo
Cecilia Sandra Hurtado Monrroy1,
Pilar Asunción Soledispa Cañarte1
![]()
1Universidad De Guayaquil, Facultad De Ciencias Químicas. Guayaquil, Ecuador.
Citar como: Hurtado Monrroy CS, Soledispa Cañarte PA. Esquemas de tratamientos más utilizados para pacientes Covid-19 en UCI y emergencia del Hospital Teodoro Maldonado Carbo. Health Leadership and Quality of Life. 2022; 1:88. https://doi.org/10.56294/hl202288
Enviado: 21-07-2022 Revisado: 09-10-2022 Aceptado: 04-12-2022 Publicado: 05-12-2022
Editor: PhD.
Prof. Neela Satheesh ![]()
ABSTRACT
This study will serve as the basis to guarantee optimal care for patients with Covid19 in critical areas of the Teodoro Maldonado Carbo Hospital in the City of Guayaquil. The objective was to analyze the therapeutic schemes used for the treatment of Covid-19 in hospitalized patients, by reviewing clinical records. The methodology was based on a retrospective cross-sectional study, in which 305 randomly selected clinical records of patients with a positive diagnosis were analyzed, with a degree of saturation below 90 % from March 1 to May 31, 2020, The results determined that the most used therapeutic scheme was Scheme # 1 with 55,73 % validated based on the deceased and discharged patients, the same one that was not the most effective, considering that 81,18 % of the patients died. compared to the 18,82 % who left discharged. The incidence of fatality in deceased patients was affected by the pre-existing diseases that the patients had, thus we have that of the 305 patients admitted, 82,95 % had pre- existing diseases, of which 81 % died. In conclusion, it is found that having pre-existing diseases considerably affects the deterioration of patients who contract Covid-19, so choosing the correct therapeutic scheme increases the possibility of success in the care of Covid19 patients.
Keywords: Therapeutic Scheme; Covid-19; Intensive Care; Patients.
RESUMEN
Este estudio servirá como base para garantizar una atención óptima a los pacientes con Covid19 en las áreas críticas del Hospital Teodoro Maldonado Carbo de la Ciudad de Guayaquil. El objetivo fue analizar los esquemas terapéuticos utilizados para el tratamiento Covid-19 en pacientes hospitalizados, mediante la revisión de fichas clínicas. La metodología se basó en un estudio retrospectivo de corte transversal, en el que se analizaron 305 fichas clínicas seleccionadas al azar de pacientes con diagnóstico positivo, con grado de saturación por debajo de los 90 % desde el 1 de marzo al 31 de mayo del 2020. Los resultados determinaron que el esquema terapéutico más utilizado fue el Esquema # 1con un 55,73 % validado en función de los pacientes fallecidos y dados de alta, el mismo que no fue el más eficaz, considerando que el 81,18 % de los pacientes fallecieron, en comparación del 18,82 % que salió de alta. La incidencia de la letalidad en pacientes fallecidos se vio afectada por las enfermedades preexistentes que poseían los pacientes, así tenemos que de los 305 pacientes ingresados el 82,95 % presento enfermedades preexistentes de los cuales el 81 % fallecieron. En conclusión, se comprueba que el tener enfermedades preexistentes afecta considerablemente en el deterioro de los pacientesque contraen Covid-19, por lo que escoger el esquema terapéutico correcto aumenta la posibilidad de éxito en la atención de pacientes Covid19.
Palabras clave: Esquema Terapéutico; Covid-19; Cuidado Intensivo; Pacientes.
INTRODUCCIÓN
Con la aparición de la epidemia del Síndrome Respiratorio Agudo Severo (SARS) en el 2002 y 2003 en la provincia de Guangdong en China.(1,2,3) Hasta ese momento, las infecciones causadas por coronavirus en humanos sólo generaban infecciones leves en pacientes inmunocompetentes.(4,5,6) Gracias a los esfuerzos de la OMS en la identificación de casos, aislamiento (cuarentena) y seguimiento de pacientes que hubiesen estado en contacto con pacientes contagiados, la epidemia de SARS pudo ser controlada en poco tiempo y con pocas víctimas mortales. No se han reportado más casos de SARS desde el 2004. En total, hubo un aproximado de 8096 casos comprobados en 29 países, dejando un saldo de 774 personas fallecidas.(7,8,9)
Diez años después, en el año 2012, emergió otro coronavirus altamente patógeno en países del medio este, identificado por primera vez en Arabia Saudita, el Coronavirus causante del Síndrome Respiratorio del Medio Este (MERS-CoV).(10,11,12) Ambos, el SARS-CoV y MERS-CoV, fueron transmitidos de animales a humanos, desde una civeta y un camello dromedario respectivamente, pero se piensa que ambos virus fueron originados en murciélagos.(13,14,15)
En caso del SARS-CoV y MERS-CoV se presentaron sintomatologías similares y varios factores de riesgo en común como: edad avanzada, sexo masculino y la presencia de comorbilidades; para el MERS fue: diabetes mellitus, hipertensión, cáncer, confecciones, enfermedad renal y pulmonar, todas estas se asociaron a un mal pronóstico.(16,17,18) Sin embargo, se presentaron importantes diferencias, en SARS entre el 20-30 % de los pacientes requirieron cuidados intensivos con ventilación mecánica con una letalidad aproximada al 10 %; en comparación el MERS el 50-89 % de los pacientes requirió de cuidados intensivos y la tasa de letalidad estuvo alrededor del 36 %.(19,20,21) La letalidad bruta de los casos clínicos de SARS CoV2. Supera actualmente el 3 %, aunque aumenta con la edad hasta aproximadamente el 15 % o más en pacientes mayores de 80 años.(22,23,24)
En diciembre del 2019, la provincia de Hubei en Wuhan, China, se convirtió en el epicentro de un brote de neumonía de causas desconocidas.(25,26,27) Un grupo de pacientes se presentó a diferentes hospitales con diagnósticos de neumonía de etiología no conocida.(28,29,30) La mayoría de estos pacientes fueron vinculados epidemiológicamente a un mercado mayorista de pescados, mariscos y animales vivos y no procesados en la provincia de Hubei.(31,32,33)
Durante el 18 de diciembre y el 29 de diciembre del 2019, se reportaron los primeros cinco casos, de los cuales cuatro de estos pacientes fueron hospitalizados por presentar síndrome de distrés respiratorio agudo y uno de estos pacientes falleció) La mayoría de los pacientes aseguraron tener relación directa o indirecta con un mercado de alimentos en la provincia de Hubei en Wuhan.(34,35,36)
Ya para el 1ero de enero del 2020, el mercado de Wuhan había sido cerrado y no existía evidencia clara de transmisión persona a persona.(37,38,39) El 2 de enero, un total de 41 pacientes habían sido hospitalizados y sólo un paciente que presentaba patologías preexistentes serias, había fallecido.(40,41,42) El 7 de enero, las autoridades chinas anunciaron que habían identificado un nuevo tipo de coronavirus (Nuevo Coronavirus, 2019-nCoV) A partir de este momento las autoridades a nivel mundial supieron que enfrentaban una nueva amenaza.(43,44,45)
Para este momento, solo se les había realizado pruebas a las personas que presentaban sintomatología.(46,47,48) Tan solo diez días después, un total de 571 casos habían sido reportados en 25 diferentes provincias en toda China, mientras que en la provincia de Hubei las muertes habían alcanzado a 17, y se mantenían 95 pacientes en estado crítico.(49,50,51) Se realizó un estimado según el Modelo de Enfermedades Infectocontagiosas del Centro de Colaboración de la OMS y la proyección alcanzaba a 4000 posibles contagiados, pudiendo llegar a casi 10 000.(52,53)
A partir de ahí, el número de pacientes contagiados fue aumentando exponencialmente en China continental, y para el 30 de enero se habían reportado 9692 casos en toda China y 90 casos en diferentes países incluyendo Taiwán, Tailandia, Vietnam, Malasia, Nepal, Sri Lanka, Camboya, Japón, Singapur, la República de Corea, Emiratos Árabes Unidos, Estados Unidos, Filipinas, India, Irán, Australia, Canadá, Finlandia, Francia y Alemania.(54,55,56) El 11 de marzo, con 118 000 casos reportados en 114 países y 4291 personas fallecidas, la Organización Mundial de la Salud declara que el brote de la enfermedad del Coronavirus 19 causada por el SARS-CoV2, es considerada una pandemia.(57,58,59)
El primer reporte de caso en el continente americano surgió el 19 de enero 2020 en el estado de Washington, en Estados Unidos; un paciente masculino de 35 años, con una historia de tos y fiebre, acudió a un centro de salud solicitando atención médica.(60,61,62) En sus antecedentes estaba un viaje de visita familiar a Wuhan, China. Asimismo, el 24 de enero se reporta el primer caso de Covid-19 en Europa, específicamente en Bordeaux, Francia, de una paciente con historia reciente de haber visitado China.(63,64,65) El 26 de febrero del presente año el Ministerio de Salud de Brasil, reporta el primer caso de COVID-19 en Suramérica; un hombre de 61 años de São Paulo, con historia reciente de viaje a Lombardía, Italia, presentó síntomas leves y fue sometido a cuarentena.(66,67) En Venezuela, el 13 de marzo, una mujer de 41 años que estuvo de viaje en España, Italia y Estados Unidos, resultó positiva a la prueba de SARS-CoV2 en el Hospital Clínico Universitario.(68,69)
Entre el 1 y el 14 de febrero de 2020 llegaron a Ecuador alrededor de 20 000 personas desde EEUU, España e Italia, países en los que el coronavirus empezaba a expandirse exponencialmente para convertirse en la pandemia que el mundo vive actualmente.(70,71)
Entre los pasajeros que arribaron desde España se encontraba la mujer que, días después, fue confirmada como el primer caso de coronavirus en el país. Ella llegó el 14 de febrero, pero los primeros síntomas aparecieron al día siguiente. Debido a las complicaciones en su estado de salud fue internada en un hospital de Guayaquil, en donde falleció el 13 de marzo.(72,73)
Pero, ahora se sabe que el 29 de febrero, cuando el Ministerio de Salud confirmó que la mujer estaba contagiada con el virus, al menos 24 personas ya tenían síntomas de coronavirus en Ecuador antes de que las autoridades confirmaran que el virus estaba en el país.(74,75,76)
La Covid-19, ha originado una emergencia sanitaria, económica, social y ambiental a nivel mundial. En muy corto tiempo se ha convertido en pandemia con tres características definidas: rapidez-escala, gravedad y perturbación socioeconómica.(77,78,79) Al 30 de abril 2021 se reporta circulación en 180 países, aproximadamente 152,2 millones de casos y más de 3,1 muertes.(80) El 80 % de los contagiados experimenta síntomas leves similares a los de una gripe común o son asintomáticos, los casos severos acaban en neumonía y requieren de cuidados intensivos con ventilación mecánica. Los factores de riesgo asociados a severidad incluyen enfermedades subyacentes y edad avanzada.(81) En tiempo récord (cuatro semanas) se identificó a un nuevo coronavirus como el agente causal (SARS CoV 2), se secuenció y se publicó su genoma, se desarrollaron pruebas diagnósticas (RT-PCR en tiempo real).(82,83)
Se considera que, además de medidas de salud pública basadas en pruebas, se necesitan medios de diagnóstico, tratamientos y vacunas innovadoras para hacer frente a la Covid- 19, en tiempo récord y a una escala y con unos niveles de acceso sin precedentes, la intención es salvar millones de vidas e incontables billones de dólares, y devolver al mundo a una situación de «normalidad». La lucha contra la Covid-19 es interdisciplinaria, nadie debe quedar atrás.(84,85) La OMS como autoridad sanitaria internacional activó el Plan de Investigación y Desarrollo 14, un proyecto de colaboración sin precedentes, de carácter mundial y por un periodo de tiempo limitado, cuyo objetivo es acelerar en todo el mundo el desarrollo y la producción de nuevas tecnologías sanitarias esenciales para hacer frente a la Covid-19, así como el acceso equitativo a las mismas.(86)
Aunque estamos ante una nueva pandemia muchas de las estrategias implementadas corresponden a experiencias de eventos anteriores e incluso a las experiencias de países que por cronología les ha llegado primero este azote, la falta de un tratamiento respaldado por suficiente evidencia científica ha llevado al empleo de diferentes pautas terapéuticas y modificaciones rápidas de los protocolos. Recientes revisiones y editoriales han destacado la falta de terapias probadas y la necesidad de ensayos clínicos que permitan establecer pautas de tratamiento basadas en la evidencia.(87,88,89)
Estos hechos no tienen precedente en la historia reciente de la humanidad y su impacto sólo va a ser mitigado a través del esfuerzo coordinado de las autoridades sanitarias y demás sectores de la sociedad. En la medida en que se propenda por acciones de solidaridad a nivel de cada país e internacionalmente, las estrategias de prevención primaria y secundaria servirían como complemento para el control del SARS CoV 2 en materia de salud colectiva.
¿Resultaran efectivos algunos de los esquemas terapéuticos recomendados para el tratamiento del Covid-19 en el Hospital del IESS Teodoro Maldonado Carbo?
Objetivo
Analizar los esquemas terapéuticos utilizados para el tratamiento Covid-19 en pacientes hospitalizados, mediante la revisión de fichas clínicas de los pacientes que ingresaron a las UCI y Emergencia con diagnóstico positivo, obtenidas del sistema AS400 del HTMC.
MÉTODO
Enfoque de la investigación
El presente enfoque de este estudio es cuantitativo los datos se recopilaron de la historia clínica electrónicas del sistema AS400 de pacientes hospitalizados Covid-19.
Modalidad de la investigación
Este estudio se realizó de forma bibliográfica documental.
Tipo de investigación
Este proyecto es un estudio retrospectivo de corte transversal, de tipo descriptivo el cual se recopilo la información de fichas clínicas de las unidades críticas del Hospital Dr. Teodoro Maldonado Carbo desde el 1 de marzo al 31 de mayo 2020.
Población y muestra
La población de este estudio considera a todos los pacientes que ingresaron a las unidades críticas del HTMC con grado de saturación menor a 95 y diagnóstico de radiografía de pulmón positivo de los cuales se seleccionó 305 pacientes que cumplieron con los criterios establecidos durante el periodo de marzo a mayo del 2020.
Operacionalización de variables
|
Tabla 1. Operacionalización de las variables |
|||
|
Tipo variables |
Dimensión |
Instrumento |
Unidad de medida |
|
Independiente |
Esquemas de tratamiento |
Cálculos de la cantidad usado de Antibióticos, Antimicrobianos. Corticoides, Anticoagulantes |
Determinación en % |
|
Dependiente |
Pacientes |
Pacientes fallecidos |
Determinación en % |
|
Pacientes de alta médica |
Determinación en % |
||
|
Intervinientes |
Género |
Masculino, Femenino |
Determinación en % |
|
Antecedentes patológicos |
HTA, DM-I, DM-II, ERA |
Determinación en % |
|
|
Edad |
Fecha de Nacimiento |
Determinación en % |
|
Hipótesis: existen esquemas terapéuticos efectivos para los pacientes con Covid-19 ingresados en el área de emergencia y unidades de cuidados intensivo de marzo a mayo 2020.
Variable independiente: entre la variable independiente tenemos, el Esquema de tratamiento, la misma que se determinó por la cantidad en frecuencia que los fármacos fueron utilizados a través de la determinación por porcentaje.
Variable dependiente: como variable dependiente tenemos a los pacientes fallecidos y pacientes dados de alta cuya frecuencia está dada en porcentajes.
Técnicas e instrumentos:
1. Solicite autorización para la utilización de la información de las HC, al departamento de Docencia del hospital HTMC.
2. Se recogieron de las HC electrónicas de los pacientes Covid-19 hospitalizados diagnostico positivo. Parámetros establecidos en base a la revisión bibliográfica de diferentes estudios científicos consultados y aprobados para los tratamientos aplicados para Sars-Cov1 y MERS por la OMS.
3. Se diseñó la matriz de recolección de datos Covid-19, que son extraídos del sistema AS400 con los parámetros seleccionados edad, sexo, síntomas, grados de saturación, comorbilidades, tratamientos, altas, fallecimientos, se registrarán todos los tratamientos usados durante el ingreso.
Instrumentos:

Figura 1. Matriz de recolección de datos covid-19
Usada para la recolección de los datos como sexo, edad, antecedentes patológicos, tratamientos administrados tomados del sistema AS400.
Validez y confiabilidad
Esta matriz se la diseñara en base a los estudios de Fujun Peng, Ph.D., Yongshi Yang, M.D. Management and Treatment of COVID-19, Promising and potential drugs for the treatment of COVID-19 en el que se describen paramentos similares, la forma y enfoque serán a criterio del investigador.
Su función es la de recolectar los datos obtenidos de las fichas clínicas de los 305 pacientes del sistema AS400, esta matriz está clasificada por edad, sexo, síntomas, antecedentes patológicos, fármacos de las enfermedades preexistentes, días de estancia hospitalaria, y fármacos administrados durante la estancia hospitalaria y al final si salió de alta o falleció. La forma como se tabularon los datos fue mediante filtración, y con esos resultados clasificarlos y representarlos gráficamente.
Plan para recolección de información
La recolección de datos se realizó a través del sistema AS400, de donde se tomaron las historias clínicas electrónicas de todos los pacientes que ingresaron con diagnostico positivo para Covid-19 previo Tomografía computarizada. Una vez validada toda la población se procede al cálculo de la muestra con la que vamos a trabajar X pacientes de donde se obtendrán los parámetros establecidos en la matriz base de datos Covid-19.
Plan de procesamiento de información
La información proporcionada por las historias clínicas tomadas del sistema AS400-fue codificada en una matriz computacional denominada Matriz Base de Datos Covid19 de Microsoft Excel, office 2013, mientras que para su validación y análisis de los datos recolectados se utilizó el programa estadístico ALFA DE CRONBACH, el cual permitió la depuración de los datos, la generación de resultados estadísticos y la preparación para el análisis y su difusión tabular los datos y realizar la representación gráfica de los resultados más significativo se inherentes al problema en estudio.
RESULTADOS
Análisis e interpretación de los resultados
|
Tabla 2. Esquemas de tratamientos utilizados para pacientes Covid-19 |
|
|
Esquema # 1 170 pacientes |
|
|
Fármacos |
Porcentajes de utilización |
|
Ampicilina +Sulbactan IV 1,5 a 3 g Tid o Quid |
55,73 |
|
Azitromicina VO 500 mg Qd |
39,41 |
|
Claritromicina IV 500 mg Bid |
48,19 |
|
Cloroquina 250- 500 mg Bid x 10 d |
87,05 |
|
Oseltamivir 75-150 mgBid x 5 |
57,64 |
|
Lopinavir+Ritonavir 200+50 mg 2 tab bid x 14 d |
19,41 |
|
Enoxaparina 40 y 60 UI |
51,76 |
|
Tocilizumab 400 stat 200 mg bid |
8,23 |
|
Esquema # 2 92 pacientes |
|
|
Fármacos |
Porcentajes de utilización |
|
Ceftriazona IV 1 a 2 g Bid |
30,16 |
|
Azitromicina VO 500 mg Qd |
47,86 |
|
Claritromicina IV 500 mg Bid |
21,31 |
|
Cloroquina 250- 500 mg Bid x 10 d |
82,9 |
|
Oseltamivir 75-150 mgBid x 5 |
18,47 |
|
Lopinavir+Ritonavir 200+50 mg 2 tab bid x 14 d |
16,06 |
|
Enoxaparina 40 y 60 UI |
71,73 |
|
Tocilizumab 400 stat 200 mg bid |
7,6 |
|
Esquema #3 30 pacientes |
|
|
Fármacos |
Porcentajes de utilización |
|
Meropenen IV 1-2 g Tid |
9,8 |
|
Vancomicina IV 500 a 1g Bid |
9,8 |
|
Azitromicina VO 500 mg Qd |
43,33 |
|
Claritromicina IV 500 mg Bid |
30 |
|
Cloroquina 250- 500 mg Bid x 10 d |
63,33 |
|
Oseltamivir 75-150 mgBid x 5 |
26,66 |
|
Lopinavir+Ritonavir 200+50 mg 2 tab bid x 14 d |
13,33 |
|
Enoxaparina 40 y 60 UI |
73,33 |
|
Levofloxacina IV 500 mg IV Qd |
0,655 |
|
Linezolid IV 600 mg bid |
1,31 |
|
Tocilizumab 400 stat 200 mg bid |
0,327 |
|
Otros fármacos |
Porcentajes de utilización |
|
Amoxicilina+Ac. Clavulanico 1,2 g tid |
0,655 |
|
Cefazolina Vi 1 g bid |
0,65 |
|
Ceftazidina Vi 1 g bid |
0,327 |
|
Imipenen+Cilastina 500 mg quid |
0,327 |
|
Piperacilina+ Tazobactan IV 4,5 g Tid |
1,64 |
|
Trimetoprin+ Sulfa 800 mg tid |
0,327 |
|
Sin esquemas |
1,02 |
|
Broncodilatadores, corticoides |
|
|
Acetilcisteina 600 mg bid |
35,4 |
|
Br. Ipatropio 2 puff Tid |
14,75 |
|
Metilprednisolona 125-250 mg |
31,15 |
|
Dexametasona 8 mg Iv |
9,18 |
|
Sedantes |
|
|
Fentanilo 0,5 mg/ml 2 amp bid,Midazolan 150 mg bid, Propofol 250 mg qd, Rocuronio 250 mg qd |
60,65 |
|
Tabla 3. Eficacia de los esquemas de tratamientos utilizados para pacientes Covid-19 |
|||
|
Esquema |
Porcentajes de utilización |
Porcentajes de fallecidos |
Porcentajes de alta |
|
ESQUEMA # 1 |
55,73 |
81,18 |
18,82 |
|
ESQUEMA # 2 |
30,16 |
79,35 |
20,65 |
|
ESQUEMA # 3 |
9,8 |
70 |
30 |
|
OTROS |
4,31 |
100 |
0 |
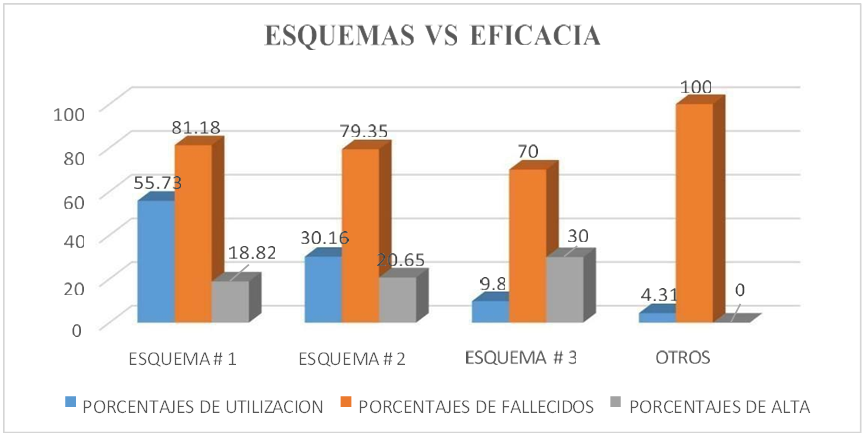
Figura 2. Los esquemas de tratamientos más utilizados en pacientes con Sars Cov-2 ingresados a las áreas críticas del HTMC
|
Tabla 4. Paciente ingresado, dados de alta y fallecido |
|||
|
Pacientes fallecidos vs dados de alta |
|||
|
|
Fallecidos |
Alta |
Total |
|
Hombres |
167 |
33 |
200 |
|
Mujeres |
71 |
34 |
105 |
|
Total pacientes |
238 |
67 |
305 |
|
Porcentaje total pctes |
78,03 |
21,97 |
100 |
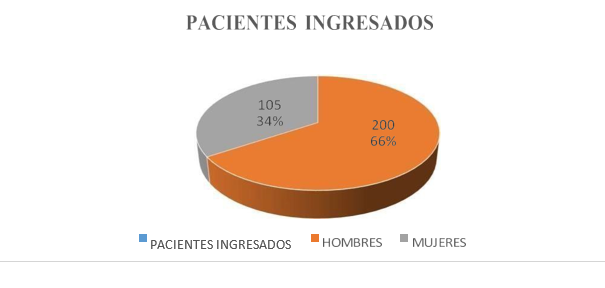
Figura 3. Predominio de pacientes masculinos sobre las pacientes femeninas con Sars Cov-2 ingresados a las áreas críticas del HTMC

Figura 4. Paciente fallecido Vs. Pacientes dados de alta del total pacientes ingresados al HTMC
|
Tabla 5. Grupo Etario Vs fallecidos |
||
|
Grupo Etario |
||
|
Edades |
Fallecidos |
Porcentaje |
|
0-19 |
1 |
0,4 |
|
20-29 |
1 |
0,4 |
|
30-39 |
8 |
3,4 |
|
40-49 |
20 |
8,4 |
|
50-59 |
41 |
17,2 |
|
60-69 |
84 |
35,3 |
|
70-79 |
50 |
21,0 |
|
81 o mas |
33 |
13,9 |
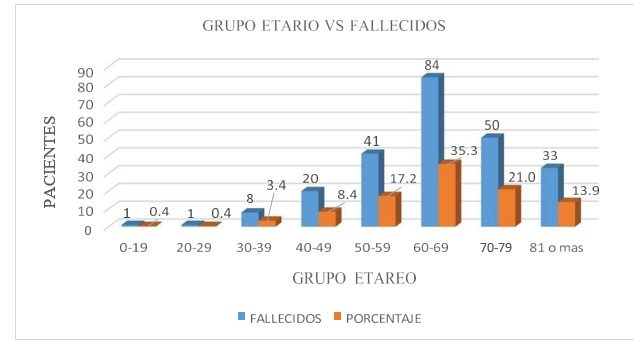
Figura 5. Pacientes fallecidos por el virus Sars Cov2 por grupos etarios
|
Tabla 6. Pacientes con o sin Antecedentes Patológicos Vs Pacientes Fallecidos y Altas |
|||
|
Antecedentes |
Total, C/S Patología |
Falleció |
Alta |
|
Antecedentes Patológicos |
253 |
205 |
48 |
|
Sin Antecedentes Patológicos |
52 |
33 |
19 |
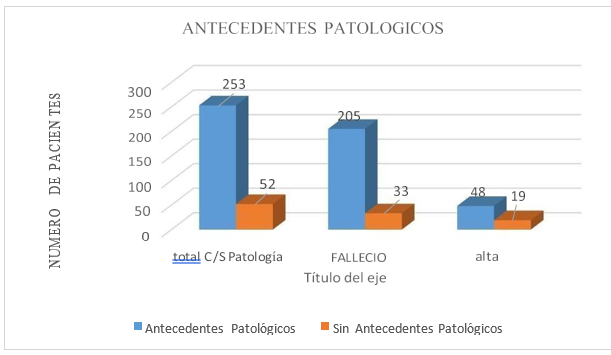
Figura 6. Pacientes con o sin Antecedentes Patológicos Vs Pacientes fallecidos o dados de alta
|
Tabla 7. Antecedente Patológico más frecuente |
|
|
Antecedentes patológicos |
Porcentaje |
|
HTA |
22,53 |
|
DM |
13,04 |
|
DM-HTA |
15,81 |
|
DM-HTA, IRC |
21,34 |
|
ASMA, EPOC, CA P |
5,93 |
|
CANCER |
2,8 |
|
HTA-HIPOT |
4,74 |
|
C.HEPATICA |
1,87 |
|
OTROS |
11,94 |
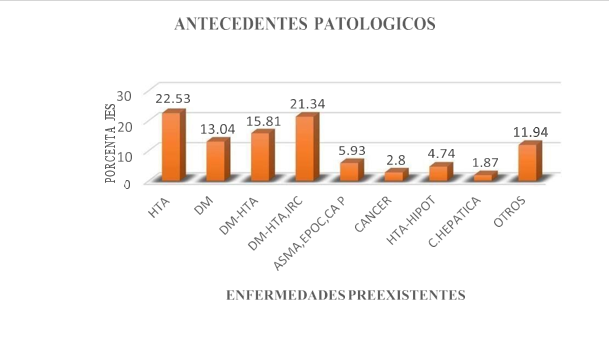
Figura 7. Enfermedades preexistentes más frecuentes entre los Pacientes con Sars cov2 que ingresaron a las Unidades críticas del HTMC
Interpretación de los resultados
La presente investigación evidencio que durante los meses de marzo, abril y mayo del 2020 los mismos que fueron los meses más críticos en cuanto a pacientes infectados con Covid-19 , se recibieron 305 pacientes en las áreas críticas del hospital Teodoro Maldonado Carbo en los que se utilizaron 3 esquemas de tratamiento para los pacientes que ingresaron como se lo evidencia en la tabla 2 y 3 y en su representación gráfica en la figura 2 siendo el esquema 1 el más utilizado con Ampicilina +Sulbactan IV 1,5 a 3 g Tid o Quid en un 55,73 % correspondiente a 170 pacientes, como segundo esquema de tratamiento utilizado por 92 pacientes fue la Ceftriaxona en 1 a 2 g bid con un 30,16 % y un tercer esquema utilizado por 30 pacientes en un 9,8 %, así también otros esquemas utilizados en u 4,31 % que llegaron a 13 pacientes entre estos Amoxicilina +Ac Clavulanico 1,2 g tid, Cefazolina 1 g bid, Imipenen+ Cilastina 500 mg quid y Piperacilina+ Tazobactan 4,5 g quid. Estos esquemas de tratamientos Estuvieron complementados por broncodilatadores, Corticoides y Sedantes como Propofol, Midazolan, Rocuronio y Fentanilo en un 60,65 % cuando lospacientes fueron entubados.
Estudio realizado en China titulado Management and Treatment of COVID- 19: The Chinese Experience. Realizado por Fujun Peng, Ph.D., Yongshi Yang, M.D. en 327 pacientes, Nos muestra que el 87,3 % (254/291) pacientes recibieron tratamiento con antibióticos, el 61,5 % (201/327) pacientes recibieron tratamiento antiviral, el 53,8 % (176/327) recibieron tratamiento con corticosteroides y el 41,0 % (114/278) recibieron inmunoglobulina intravenosa. Solo el 8,4 % (23/274) pacientes recibieron terapia de reemplazo renal continua, En comparación con nuestros datos obtenidos podemos observar que existe una similitud en cuanto a esquemas de tratamientos en el uso de Antibióticos, Antivirales, Corticoides.
Comparando el estudio realizado en el HTMC con el Chen et al. en el que Informaron que 75 de 99 pacientes confirmados en Wuhan recibieron tratamiento antiviral, incluido oseltamivir, ganciclovir y lopinavir / ritonavir. La duración del tratamiento antiviral fue de 3-14 días. Sin embargo, los resultados de un ensayo clínico de lopinavir / ritonavir en China no mostraron un beneficio claro. Más allá de la atención estándar en pacientes adultos hospitalizados con Covid-19. Podemos observar que los pacientes del HTMC también utilizaros terapia con antivirales como el Oseltamivir x 5 días, en un 57,64 %, Lopinavir+Ritonavir x 14 días en un 19,41 % sin embargo al igual que el estudio realizado por Chen et al. no se mostraron mayores beneficios.
Cabe destacar que de los 305 pacientes críticos validados a través de un TAC de pulmón y su grado de saturación menor a 95 % 200 pacientes recibidos fueron de sexo masculino con un 65,57 % y 105 pacientes femeninas con un 34,35 % como se evidencia en la figura 3 así también se puede evidenciar en la tabla 4 y figura 4 la incidencia de Fallecidos fue más en hombres que en mujeres así tenemos que de 305 pacientes 238 fallecieron correspondiente a un 78,03 % de los 238 pacientes fallecidos 167 fueron masculinos correspondientes a un 70,17 % y 71 pacientes femeninas con un 28,83 %, en cuanto a los 67 pacientes que salieron de Alta correspondiente a un 21,97 %, 50,75 % fueron pacientes femeninas y el 49,25 % masculinos.
Según El Studio Management and Treatment of COVID-19: The Chinese Experience. En 327 pacientes, Nos muestra que. La tasa de mortalidad de los 327 casos agrupados graves fue del 25,4 % (83/327). Lo que difiere de los resultados obtenidos en el HTMC donde de 305 pacientes analizados la tasa de mortalidad fue del 78,03 %.
En los pacientes HTMC también se evidencio que el grupo etario con más pacientes fallecidos como se muestra en la tabla y figura 5 fue el comprendido entre 60-69 años con un 35 %, seguido del grupo de 70-79 años con un 21 %, 50-59 con un 17 %, el grupo 80 o más con un 13,9 %, 40-49 con un 8,4 %, 30-39 4 %, presentando una similitud con el estudio realizado por Cárcamo, Tejeda y colaboradores quienes realizaron en Colombia un estudio de datos recopilados de diferentes hospitales entre el 6 de marzo al 15 de mayo del 2020 indicaron que de 14 216 casos de infectados con SARS-CoV-2, se encontró, El 60,8 % de los fallecidos fueron hombres, la mediana de edad fue de 69 años (RIC: 59 – 69) con un rango de 0 años (3 recién nacidos) a 98 años; el mayor número de casos se presentaron en individuos con una edad igual o superior a 60 años (73,2 %); se representan las proporciones por grupo de edades. 474 personas (86,8 %) con condiciones clínicas asociadas. , estos resultados nos corroboran que la tendencia es muy parecida en ambos países.
En la tabla y figura 6 podemos observar que de los 305 pacientes ingresados a las Unidades Criticas del HTMC el 82,95 % tenían Antecedentes Patológicos de los cuales el 81 % fallecieron y el 19 % salió de Alta Vs. El 17,05 no tenían ningún Antecedente Patológico, de los cuales el 63 % falleció y el 36 % salió de Alta, al igual que el estudio de Cárcamo, Tejeda y colaboradores realizaron en Colombia un estudio de datos recopilados 14 216 casos de infectados con SARS-CoV-2, se encontró comorbilidades de 546 fallecidos (estimándose para esta fecha una tasa de letalidad de 3,84 %). Se incluyeron en este estudio todos los fallecidos en el territorio nacional.
Entre las enfermedades preexistentes más comunes que presentaron estos 253 pacientes como se evidencia en la tabla 7 y figura 7 fueron la HTA con un 22,53 %, DM con un 13,04 %, DM+HTA 15,81 %, DM+HTA+IRC 21,34 %, ASMA, EPOC, CA PULMON 5,93 %, CA 2,8 %, HTA+HIPOT 4,74 %, CIRROSIS 1,87 % OTRAS 11,94 % al igual que el estudio de Cárcamo, Tejeda y colaboradores realizaron en las comorbilidades más comunes encontrados fueron hipertensión arterial (207/546, 37,9 %), diabetes mellitus (102/546, 18,7 %), seguidos por la enfermedad pulmonar obstructiva crónica (95/546, 17,3 %), antecedente de cardiopatía (83/546, 15,2 %) y obesidad (62/546, 11,3 %). Cuando se discrimina la prevalencia de condiciones por grupo de edades en la primera infancia es más frecuente la presencia de cardiopatías congénitas, en la juventud la infección por el virus de la inmunodeficiencia humana (VIH) y en la vejez hipertensión arterial 25 Zheng Z realizó una revisión sistemática y meta analizaron los factores de riesgo asociados a mortalidad y estado crítico 86 encontrando que la proporción de enfermedades subyacentes como hipertensión, diabetes, enfermedad cardiovascular y enfermedad respiratoria fue estadísticamente significativa más alta en pacientes críticos mortales en comparación con los pacientes no críticos (diabetes: OR = 3,68, IC 95 % (2,68, 5,03), P<0,00001; hipertensión: OR = 2,72, IC 95 % (1,60, 4,64), P = 0,0002; Enfermedad cardiovascular: OR = 5,19, IC 95 % (3,25, 8,29), P<0,00001; enfermedad Respiratoria: OR = 5,15, 95 % CI (2,51, 10,57), P <0,00001). Estos datos apoyan los hallazgos de la investigación pues en Colombia la enfermedad cardiaca, pulmonar crónica y la diabetes tienen una prevalencia mayor de 10 %. Teniendo en cuenta todos estos hallazgos se sigue confirmando la hipótesis en donde el incremento de la edad y la presencia de enfermedades concomitantes.
CONCLUSIONES
Una vez Analizados los esquemas terapéuticos utilizados para el tratamiento Covid-19 en pacientes hospitalizados, mediante la revisión de fichas clínicas de los pacientes que ingresaron a las UCI y Emergencia con diagnostico positivo, obtenidas del sistema AS400 del HTMC se estableció el esquema terapéutico más usado para pacientes Covid -19 ingresados en el área de emergencia y UCI del Hospital Teodoro Maldonado se determinó:
El esquema terapéutico más utilizado fue el Esquema # 1 con un 55,73 % comprendido por Ampicilina + Sulbactan IV 1,5 a 3 g Tid o Quid, Azitromicina VO 500 mg Qd, Claritromicina IV 500 mg Bid, Cloroquina 250- 500 mg Bid x 10 d, Oseltamivir 75-150 mgBid x 5, Lopinavir+Ritonavir 200+50 mg 2 tab bid x 14 d, Tocilizumab 400 stat 200 mg bid. Complementado con broncodilatadores y Corticoides.
Una vez analizado el esquema terapéutico más utilizado y validado en función de los pacientes fallecidos y dados de alta, se puede concluir que este esquema no fue el más eficaz, es así como del 55,73 % de pacientes el 81,18 % de los pacientes fallecieron Vs el 18,82 % que salió de alta.
Cabe destacar que la incidencia de la letalidad en pacientes fallecidos se vio afectada por las enfermedades preexistentes que poseían los pacientes, tales como Hipertensión, Diabetes Mellitus 1 o 2, Insuficiencia Renal Crónica con estadio 5, Cáncer en los Diferentes órganos, Cirrosis hepática, Hipotiroidismo, Asma, Epoc y en muchos de los casos presentaron una asociación de varias de ellas, así tenemos que de los 305 pacientes ingresados el 82,95 % presento enfermedades preexistentes de los cuales el 81 % fallecieron, por lo que podemos concluir que el tener enfermedades preexistentes si afecta en el deterioro de los pacientes que contraen Covid-19 y en su gran mayoría esto los conduce a una muerte segura.
En conclusión, podemos decir que no existió esquemas terapéuticos efectivos para los pacientes con Covid-19 ingresados en el área de emergencia y unidades de cuidados intensivo de marzo a mayo 2020. Lo que se evidencio a través de la tasa de pacientes fallecidos vs los pacientes dados de alta.
REFERENCIAS BIBLIOGRÁFICAS
1. Cui J, Li F, Shi ZL. Origin and evolution of pathogenic coronaviruses. Nat Rev Microbiol. 2019;17(3):181–92. doi: 10.1038/s41579-018-0118-9.
2. Zhong NS, Zheng BJ, Li YM, et al. Epidemiology and cause of severe acute respiratory syndrome (SARS) in Guangdong, People’s Republic of China, in February 2003. Lancet. 2003;362(9393):1353–8. doi: 10.1016/S0140-6736(03)14630-2.
3. Marty AM, Jones MK. The novel Coronavirus (SARS-CoV-2) is a one-health issue. One Health. 2020;9:100123. doi: 10.1016/j.onehlt.2020.100123.
4. de Wit E, van Doremalen N, Falzarano D, Munster VJ. SARS and MERS: recent insights into emerging coronaviruses. Nat Rev Microbiol. 2016;14(8):523–34. doi: 10.1038/nrmicro.2016.81.
5. Du Toit A. Outbreak of a novel coronavirus. Nat Rev Microbiol. 2020;18(3):123. doi: 10.1038/s41579-020-0332-0.
6. Lu H, Stratton CW, Tang YW. Outbreak of pneumonia of unknown etiology in Wuhan, China: the mystery and the miracle. J Med Virol. 2020;92(4):401–2. doi: 10.1002/jmv.25678.
7. Lu H. Drug treatment options for the 2019-new coronavirus (2019-nCoV). BioSci Trends. 2020;14(1):69–71. doi: 10.5582/bst.2020.01020.
8. Wang W, Tang J, Wei F. Updated understanding of the outbreak of 2019 novel coronavirus (2019‐nCoV) in Wuhan, China. J Med Virol. 2020;92(4):441–7. doi: 10.1002/jmv.25689.
9. Organización Mundial de la Salud. OMS: Virtual press conference on COVID-19 – 11 March 2020. [Internet]. [citado 2020 mar 20]. Disponible en: https://www.who.int/docs/default-source/coronaviruse/transcripts/who-audio-emergencies-coronavirus-press-conference-full-and-final-11mar2020.pdf.
10. Folha de S. Paulo. Brasil confirma primeiro caso do novo coronavírus. [Internet]. [citado 2020 mar 19]. Disponible en: https://www1.folha.uol.com.br/equilibrioesaude/2020/02/brasil-confirma-primeiro-caso-do-novo-coronavirus.shtml.
11. Elnacional.com. Confirman primer caso de coronavirus en Venezuela. [Internet]. [actualizado 2020 mar 13; citado 2020 mar 18]. Disponible en: https://www.elnacional.com/venezuela/confirman-primer-caso-de-coronavirus-en-venezuela/.
12. Mehand MS, Al-Shorbaji F, Millett P, Murgue B. The WHO R&D Blueprint: 2018 review of emerging infectious diseases requiring urgent research and development efforts. Antiviral Res. 2018;159:63–7. doi: 10.1016/j.antiviral.2018.09.009.
13. Organización Mundial de la Salud. Pandemia de enfermedad por coronavirus (COVID-19). [Internet]. [citado 2020 abr 26]. Disponible en: https://www.who.int/csr/don/12-january-2020-novel-coronavirus-china/es/.
14. Devaux CA, Rolain JM, Colson P, Raoult D. New insights on the antiviral effects of chloroquine against coronavirus: what to expect for COVID-19? Int J Antimicrob Agents. 2020;105938. doi: 10.1016/j.antiviral.2020.105938.
15. Wellems TE, Plowe CV. Chloroquine-resistant malaria. J Infect Dis. 2001;184(6):770–6. doi: 10.1086/322858.
16. Enrique Asensio, Rafael Acunzo, William Uribe, Eduardo B. Saad, Luis C. Sáenz. Recomendaciones para la medición del intervalo QT durante el uso de medicamentos para el tratamiento de infección por COVID-19. [Internet]. Disponible en: http://www.covid19-druginteractions.org/.
17. Woosley R. Cardiac complications of chloroquine-based therapy. Cardiology. 2020. Disponible en: https://www.practiceupdate.com/content/cardiac-complications-of-chloroquinebased-therapy/98054.
18. Organización Mundial de la Salud. Infectious disease outbreaks. [Internet]. Consultado 2020 abr 27. Disponible en: http://www.who.int/ethics/publications/infectious-disease-outbreaks/en/.
19. Cepelowicz Rajter J, Sherman M, Fatteh N, Vogel F, Sacks J, Rajter JJ. ICON (Ivermectin in COVID Nineteen): el uso de ivermectina se asocia con una menor mortalidad en pacientes hospitalizados con COVID-19. medRxiv. 2020. doi: 10.1101/2020.06.06.20124461.
20. Chaccour CJ, Brew J, García A. Ivermectin and COVID-19: how a flawed database shaped the COVID-19 response of several Latin American countries. [Internet]. Instituto de Salud Global de Barcelona; 2020. Disponible en: https://www.isglobal.org/en/healthisglobal/-/custom-blog-portlet/ivermectin-and-covid-19.
21. Zhou F, Yu T, Du R, et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet. 2020;395:1054–62. doi: 10.1016/S0140-6736(20)30566-3.
22. Sanders JM, Monogue ML, Jodlowski TZ, Cutrell JB. Pharmacologic treatments for coronavirus disease 2019 (COVID-19): A review. JAMA. 2020. doi: 10.1001/jama.2020.6019.
23. Xu K, Cai H, Shen Y, et al. [Management of corona virus disease-19 (COVID-19): the Zhejiang experience]. Zhejiang Da Xue Xue Bao Yi Xue Ban. 2020;49(1):0.
24. Chen N, Zhou M, Dong X, et al. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. Lancet. 2020;395:507–13. doi: 10.1016/S0140-6736(20)30211-7.
25. Cárcamo LM, Tejeda MJ, Castro-Clavijo JA, et al. Características clínicas y sociodemográficas de pacientes fallecidos por COVID-19 en Colombia. Repertorio de Medicina y Cirugía. 2020;29(2):e202002.
26. Wang Y, Zhang D, Du G, et al. Remdesivir in adults with severe COVID-19: a randomized double-blind placebo-controlled, multicenter trial. Lancet. 2020;395:1569–78. doi: 10.1016/S0140-6736(20)31022-9.
27. Beigel JH, Tomashek KM, Dodd LE, et al. Remdesivir for the treatment of COVID-19—Preliminary report. N Engl J Med. 2020. doi: 10.1056/NEJMoa2007764.
28. Cao B, Wang Y, Wen D, et al. A trial of lopinavir–ritonavir in adults hospitalized with severe COVID-19. N Engl J Med. 2020. doi: 10.1056/NEJMoa2001282.
29. Hung IFN, Lung KC, Tso EYK, et al. Triple combination of interferon beta-1b, lopinavir–ritonavir, and ribavirin in the treatment of patients admitted to hospital with COVID-19: an open-label, randomized, phase 2 trial. Lancet. 2020;395(10238):1695–704. doi: 10.1016/S0140-6736(20)31042-4.
30. Zhou D, Dai SM, Tong Q. COVID-19: a recommendation to examine the effect of hydroxychloroquine in preventing infection and progression. J Antimicrob Chemother. 2020. doi: 10.1093/jac/dkaa114.
31. Rosenberg ES, Dufort EM, Udo T, et al. Association of treatment with hydroxychloroquine or azithromycin with in-hospital mortality in patients with COVID-19. JAMA. 2020;323(24):2493–502. doi: 10.1001/jama.2020.8865.
32. Borba MGS, Val FFA, Sampaio VS, et al. Effect of high vs low doses of chloroquine diphosphate as adjunctive therapy for patients hospitalized with SARS-CoV-2 infection: A randomized clinical trial. JAMA Netw Open. 2020;3:e208857. doi: 10.1001/jamanetworkopen.2020.8857.
33. Wu C, Chen X, Cai Y, et al. Risk factors associated with acute respiratory distress syndrome and death in patients with COVID-19 pneumonia in Wuhan, China. JAMA Intern Med. 2020. doi: 10.1001/jamainternmed.2020.0994.
34. Xu X, Han M, Li T, et al. Effective treatment of severe COVID-19 patients with tocilizumab. Proc Natl Acad Sci U S A. 2020;117(20):10970–5. doi: 10.1073/pnas.2005615117.
35. Agencia Española de Medicamentos y Productos Sanitarios. Tratamientos disponibles sujetos a condiciones especiales de acceso para el manejo de la infección respiratoria por SARS-CoV-2. [Internet]. [citado 2020 jun 7]. Disponible en: https://www.aemps.gob.es.
36. Paranjpe I, Fuster V, Lala A, Russak A, Glicksberg BS, Levin MA, et al. Association of treatment-dose anticoagulation with in-hospital survival among hospitalized patients with COVID-19. J Am Coll Cardiol. 2020.
37. Duan K, Liu B, Li C, Zhang H, Yu T, Qu J, et al. Effectiveness of convalescent plasma therapy in severe COVID-19 patients. Proc Natl Acad Sci U S A. 2020.
38. Shen C, Wang Z, Zhao F, Yang Y, Li J, Yuan J, et al. Treatment of 5 critically ill patients with COVID-19 with convalescent plasma. JAMA. 2020.
39. Cepelowicz Rajter J, Sherman M, Fatteh N, Vogel F, Sacks J, Rajter JJ. Estudio ICON (Ivermectin in COVID-19): el uso de ivermectina se asocia con una menor mortalidad en pacientes hospitalizados con COVID-19. medRxiv. 2020. doi: 10.1101/2020.06.06.20124461.
40. Corsini Acuña G, Navarro Heredia L. Virus, un mundo microscópico. 1.ª ed. Santiago: Centro de Comunicación de las Ciencias; 2020. Disponible en: http://ciencias.uautonoma.cl.
41. Huang C, Wang Y, Li X, Ren L, Zhao J, Hu Y, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet. 2020;395(10223):497–506. doi: 10.1016/S0140-6736(20)30183-5.
42. Zoonosis. Wikipedia, la enciclopedia libre [Internet]. [Citado 2020 mar 4]. Disponible en: https://es.wikipedia.org/wiki/Zoonosis.
43. Fehr AR, Perlman S. Coronaviruses: An Overview of Their Replication and Pathogenesis. In: Maier HJ, Bickerton E, Britton P, editores. Coronaviruses: Methods and Protocols. New York: Springer; 2015. p. 1–23.
44. Elshabrawy HA, Fan J, Haddad CS, Ratia K, Broder CC, Caffrey M, et al. Identification of a broad-spectrum antiviral small molecule against severe acute respiratory syndrome coronavirus and Ebola, Hendra, and Nipah viruses. J Virol. 2014;88(8):4353–65. doi: 10.1128/JVI.03050-13.
45. Bosch BJ, van der Zee R, de Haan CAM, Rottier PJM. The coronavirus spike protein is a class I virus fusion protein: structural and functional characterization of the fusion core complex. J Virol. 2003;77(16):8801–11.
46. Zhang L, Shen FM, Chen F, Lin Z. Origin and evolution of the 2019 novel coronavirus. Clin Infect Dis. 2020. doi: 10.1093/cid/ciaa112.
47. Tang XL, Wu CC, Li X, Song YH, Yao XM, Wu XK, et al. On the origin and continuing evolution of SARS-CoV-2. Natl Sci Rev. 2020;1–26. doi: 10.1093/nsr/nwaa036.
48. Tian X, Li C, Huang A, Xia S, Lu S, Shi Z, et al. Potent binding of 2019 novel coronavirus spike protein by a SARS coronavirus-specific human monoclonal antibody. Emerg Microbes Infect. 2020;9(1):382–5. doi: 10.1080/22221751.2020.1729069.
49. Organización Mundial de la Salud. Breastfeeding and COVID-19. Ginebra: OMS; 2020. Disponible en: https://www.who.int/news-room/commentaries/detail/breastfeeding-and-covid-19.
50. Wu Z, McGoogan JM. Characteristics of and important lessons from the coronavirus disease 2019 (COVID-19) outbreak in China: summary of a report of 72,314 cases from the Chinese Center for Disease Control and Prevention. JAMA. 2020. doi: 10.1001/jama.2020.2648.
51. Carter JB, Saunders VA. Virology: principles and applications. 2.ª ed. Chichester: John Wiley & Sons; 2013.
52. Ávila De Tomas JF. Covid-19: patogenia, prevención y tratamiento. 4.ª ed. Madrid: Editorial Médica Panamericana; 2020. ISBN: 978-84-16861-95-8.
53. He X, Lau EH, Wu P, Deng X, Wang J, Hao X, et al. Temporal dynamics in viral shedding and transmissibility of COVID-19. Nat Med. 2020;26(5):672–5. doi: 10.1038/s41591-020-0869-5.
54. Shi H, Han X, Jiang N, Cao Y, Alwalid O, Gu J, et al. Radiological findings from 81 patients with COVID-19 pneumonia in Wuhan, China: a descriptive study. Lancet Infect Dis. 2020;20(4):425–34. doi: 10.1016/S1473-3099(20)30086-4.
55. Almazán F, Sola I, Zuñiga S, Márquez-Jurado S, Morales L, Becares M, et al. Coronavirus reverse genetic systems: infectious clones and replicons. Virus Res. 2014;189:262–70. doi: 10.1016/j.virusres.2014.05.026.
56. World Health Organization. Clinical management of severe acute respiratory infection when novel coronavirus (nCoV) infection is suspected. [Internet]. 2020. Disponible en: https://www.who.int/publications-detail/clinical-management-of-severe-acute-respiratory-infection-when-novel-coronavirus-(ncov)-infection-is-suspected.
57. Stockman LJ, Bellamy R, Garner P. SARS: systematic review of treatment effects. PLoS Med. 2006;3(9):e343. doi: 10.1371/journal.pmed.0030343.
58. Corticosteroids as adjunctive therapy in the treatment of influenza: an updated Cochrane systematic review and meta-analysis. PubMed. [Internet]. [Citado 2020 feb 6]. Disponible en: https://www.ncbi.nlm.nih.gov/pubmed/31743228.
59. Knowles SR, Phillips EJ, Dresser L, Matukas LM. Common adverse events associated with the use of ribavirin for severe acute respiratory syndrome in Canada. Clin Infect Dis. 2003;37(8):1139–42. doi: 10.1086/378304.
60. Grein J, Ohmagari N, Shin D, Díaz G, Asperges E, Castagna A, et al. Compassionate use of remdesivir for patients with severe Covid-19. N Engl J Med. 2020;382(24):2327–36. doi: 10.1056/NEJMoa2007016.
61. Scavone C, Brusco S, Bertini M, Sportiello L, Rafaniello C, Zoccoli A, et al. Current pharmacological treatments for COVID-19: what is next? Br J Pharmacol. 2020. doi: 10.1111/bph.15072.
62. Lei L, Jian-ya G. Clinical characteristics of 51 patients discharged from hospital with COVID-19 in Chongqing, China. medRxiv. 2020. doi: 10.1101/2020.02.20.20025536.
63. Boriskin YS, Leneva IA, Pecheur EI, Polyak SJ. Arbidol: A broad-spectrum antiviral compound that blocks viral fusion. Curr Med Chem. 2008;15(10):997–1005. doi: 10.2174/092986708784049658.
64. Zhu Z, Lu Z, Xu T, Chen C, Yang G, Zha T, et al. Arbidol monotherapy is superior to lopinavir/ritonavir in treating COVID-19. J Infect. 2020. doi: 10.1016/j.jinf.2020.03.060.
65. Whitty C. Dexamethasone in the treatment of COVID-19: Implementation and management of supply for treatment in hospitals. United Kingdom: Medicines and Healthcare Products Regulatory Agency; 2020.
66. Docherty AB, Harrison EM, Green CA, et al. Features of 20,133 UK patients in hospital with COVID-19 using the ISARIC WHO Clinical Characterisation Protocol: prospective observational cohort study. BMJ. 2020;369:m1985. doi: 10.1136/bmj.m1985.
67. Mallapaty S. Can COVID vaccines stop transmission? Scientists race to find answers. Nature. 2021. doi: 10.1038/d41586-021-00450-z.
68. European Centre for Disease Prevention and Control. SARS-CoV-2 increased circulation of variants of concern and vaccine rollout in the EU/EEA, 14th update. 2021. Disponible en: https://www.ecdc.europa.eu.
69. Levine-Tiefenbrun M, Yelin I, Katz R, Herzel E, Golan Z, Schreiber L, et al. Decreased SARS-CoV-2 viral load following vaccination. medRxiv. 2021. doi: 10.1101/2021.02.06.21251283.
70. Petter E, Mor O, Zuckerman N, Oz-Levi D, Younger A, Aran D, et al. Initial real-world evidence for lower viral load of individuals who have been vaccinated by BNT162b2. medRxiv. 2021. doi: 10.1101/2021.02.08.21251329.
71. Thompson MG, Burgess JL, Naleway AL, Tyner HL, Yoon SK, Meece J, et al. Interim estimates of vaccine effectiveness of BNT162b2 and mRNA-1273 COVID-19 vaccines in preventing SARS-CoV-2 infection among health care personnel, first responders, and other essential and frontline workers. MMWR Morb Mortal Wkly Rep. 2021;70(13):495–500. doi: 10.15585/mmwr.mm7013e3.
72. Polack FP, Thomas SJ, Kitchin N, Absalon J, Gurtman A, Lockhart S, et al. Safety and efficacy of the BNT162b2 mRNA COVID-19 vaccine. N Engl J Med. 2020. doi: 10.1056/NEJMoa2034577.
73. Centers for Disease Control and Prevention (CDC). Local reactions, systemic reactions, adverse events, and serious adverse events: Moderna COVID-19 vaccine. 2020. Disponible en: https://www.cdc.gov/vaccines/covid-19/info-by-product/moderna/reactogenicity.html.
74. Poland GA, Ovsyannikova IG, Kennedy RB. SARS-CoV-2 immunity: review and applications to phase 3 vaccine candidates. Lancet. 2020. doi: 10.1016/S0140-6736(20)32137-1.
75. Lehman CD, Lamb LR, D’Alessandro HA. Mitigating the impact of coronavirus disease (COVID-19) vaccinations on patients undergoing breast imaging examinations: A pragmatic approach. AJR Am J Roentgenol. 2021. doi: 10.2214/AJR.21.25688.
76. Baden LR, El Sahly HM, Essink B, Kotloff K, Frey S, Novak R, et al. Efficacy and safety of the mRNA-1273 SARS-CoV-2 vaccine. N Engl J Med. 2021;384(5):403–16. doi: 10.1056/NEJMoa2035389.
77. Stephenson KE, Le Gars M, Sadoff J, de Groot AM, Heerwegh D, Truyers C, et al. Immunogenicity of the Ad26.COV2.S vaccine for COVID-19. JAMA. 2021. doi: 10.1001/jama.2021.3645.
78. Schultz NH, Sørvoll IH, Michelsen AE, Munthe LA, Lund-Johansen F, Ahlen MT, et al. Thrombosis and thrombocytopenia after ChAdOx1 nCoV-19 vaccination. N Engl J Med. 2021. doi: 10.1056/NEJMoa2104882.
79. Greinacher A, Thiele T, Warkentin TE, Weisser K, Kyrle PA, Eichinger S. Thrombotic thrombocytopenia after ChAdOx1 nCoV-19 vaccination. N Engl J Med. 2021. doi: 10.1056/NEJMoa2104840.
80. Mahase E. Covid-19: US suspends Johnson and Johnson vaccine rollout over blood clots. BMJ. 2021;373:n970. doi: 10.1136/bmj.n970.
81. Voysey M, Clemens SAC, Madhi SA, et al.; Oxford COVID Vaccine Trial Group. Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2: an interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK. Lancet. 2021;397(10269):99–111. Disponible en: https://www.ema.europa.eu/en/news/covid-19-vaccine-astrazeneca-benefits-still-outweigh-risks-despite-possible-link-rare-blood-clots.
82. Wise J. Covid-19: European countries suspend use of Oxford-AstraZeneca vaccine after reports of blood clots. BMJ. 2021;372:n699. Disponible en: https://www.ema.europa.eu/en/news/covid-19-vaccine-astrazeneca-benefits-still-outweigh-risks-despite-possible-link-rare-blood-clots.
83. Malas MB, Naazie IN, Elsayed N, Mathlouthi A, Marmor R, Clary B. Thromboembolism risk of COVID-19 is high and associated with a higher risk of mortality: A systematic review and meta-analysis. EClinicalMedicine. 2020;29:100639. Disponible en: https://www.ema.europa.eu/en/news/covid-19-vaccine-astrazeneca-benefits-still-outweigh-risks-despite-possible-link-rare-blood-clots.
84. Coutinho JM, Zuurbier SM, Aramideh M, Stam J. The incidence of cerebral venous thrombosis: a cross-sectional study. Stroke. 2012;43(12):3375–7. Disponible en: https://www.ema.europa.eu/en/news/covid-19-vaccine-astrazeneca-benefits-still-outweigh-risks-despite-possible-link-rare-blood-clots.
85. Peng F, Yang Y. Management and Treatment of COVID-19: The Chinese Experience. Can J Cardiol. 2020. doi: 10.1016/j.cjca.2020.04.010.
86. Zheng S, Fan J, Yu F, Feng B, Lou B, Zou Q, et al. Viral load dynamics and disease severity in patients infected with SARS-CoV-2 in Zhejiang province, China, January-March 2020: retrospective cohort study. BMJ. 2020;369:m1443.
87. COVID-19 Science Advisory Table. COVID-19 science update. 2021;1(17).
88. European Medicines Agency (EMA). COVID-19 Vaccine AstraZeneca. 2021. Disponible en: https://www.ema.europa.eu/en/medicines/human/summaries-opinion/covid-19-vaccine-astrazeneca.
89. Voysey M, Costa-Clemens SA, Madhi SA, Weckx LY, Folegatti PM, Aley PK, et al. Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2: an interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK. Lancet. 2021;397:99–111.
FINANCIACIÓN
Ninguna.
CONFLICTO DE INTERÉS
Los autores declaran que no existe conflicto de intereses.
CONTRIBUCIÓN DE AUTORÍA
Curación de datos: Cecilia Sandra Hurtado Monrroy, Pilar Asunción Soledispa Cañarte.
Metodología: Cecilia Sandra Hurtado Monrroy, Pilar Asunción Soledispa Cañarte.
Software: Cecilia Sandra Hurtado Monrroy, Pilar Asunción Soledispa Cañarte.
Redacción - borrador original: Cecilia Sandra Hurtado Monrroy, Pilar Asunción Soledispa Cañarte.
Redacción - corrección y edición: Cecilia Sandra Hurtado Monrroy, Pilar Asunción Soledispa Cañarte.