doi: 10.56294/hl2024.559
ORIGINAL
Resistance phenotypes of Gram positive cocci in pediatric blood cultures
Fenotipos de resistencia de cocos Gram positivos en hemocultivos de pacientes pediátricos
Noel Suarez Reyes1 ![]() *, Miguel Luis González Martínez1
*, Miguel Luis González Martínez1 ![]() *, Kirenia Apaulaza Corrales1
*, Kirenia Apaulaza Corrales1 ![]() *, Diana Lobo Riverol1
*, Diana Lobo Riverol1 ![]() *, Leidy Liana López Ramos1
*, Leidy Liana López Ramos1 ![]() *
*
1Universidad de Ciencias Médicas de Pinar del Rio. Cuba.
Citar como: Suarez Reyes N, González Martínez ML, Apaulaza Corrales K, Lobo Riverol D, López Ramos LL. Resistance phenotypes of Gram positive cocci in pediatric blood cultures. Health Leadership and Quality of Life. 2024; 3:.559. https://doi.org/10.56294/hl2024.559
Enviado: 26-04-2024 Revisado: 26-07-2024 Aceptado: 15-11-2024 Publicado: 16-11-2024
Editor: PhD.
Prof. Neela Satheesh ![]()
Autor para la correspondencia: Noel Suarez Reyes *
ABSTRACT
Infections in pediatric ages constituye one of the biggest challenges today due to bacterial etiology related to high multidrug resistance. This research aimed to determine the resistance phenotypes in Gram positive cocci isolated in blood cultures from patients hospitalized at the Pepe Portilla Pediatric Teaching Hospital in Pinar del Rio from January, to June 2021. An observational, descriptive and cross-sectional study was carried out with a universe consisting of 433 patients of pediatric ages, of which only 44 blood cultures (10,16 %) were positive for Gram positive cocci. All variables were processed through a descriptive analysis where the number (nº) and percentage (%) were determined through the SPSS package. It was found that Staphylococcus epidermidis showed the highest percentage (77,3 %) followed by Staphylococcus aureus (16,9 %), Enterococcus spp (4,5 %) and Streptococcus pneumoniae (2,3 %). Resistance to penicillins, macrolides and clindamycin represent the largest percentage of phenotypes resistant to Gram positive cocci isolated in blood cultures of patients hospitalized in closed hospitalization services.
Keywords: Multidrug Resistance; Blood Cultures.
RESUMEN
Las infecciones en edades pediátricas constituyen uno de los desafíos más grandes en la actualidad por la etiología bacteriana relacionada con una multidrogorresistencia elevada. Esta investigación tuvo como objetivo determinar los fenotipos de resistencia en cocos Gram Positivos aislados en hemocultivos de pacientes hospitalizados en el Hospital Docente Pediátrico “Pepe Portilla” de Pinar del Rio desde enero a junio 2021. Se realizó un estudio observacional, descriptivo y transversal con un universo constituido por 433 pacientes comprendidos en edades pediátricas de las cuales solo 44 hemocultivos (10,16 %) resultaron positivos a cocos Gram positivos. Todas las variables fueron procesadas a través de un análisis descriptivo donde se determinó el número (n°) y porcentaje (%) a través del paquete SPSS. Se encontró que los Staphylococcus epidermidis mostraron el mayor por ciento (77,3 %) seguidos del Staphylococcus aureus (15,9 %), Enterococos spp. (4,5 %) y Streptococcus pneumoniae (2,3 %). La resistencia a las penicilinas, macrólidos y clindamicina representan los mayores porcientos de fenotipos resistentes a cocos Gram positivos aislados en hemocultivo de pacientes internados en servicios cerrados de hospitalización.
Palabras clave: Multidrogorresistencia; Hemocultivos.
INTRODUCCIÓN
Los antibióticos son la principal herramienta terapéutica con que cuenta el personal de salud para enfrentar las patologías infecciosas. Su valor es indiscutible, no obstante la resistencia creciente de los microorganismos a estos agentes, incluyendo los de amplio espectro, ha generado una dificultad de profundas dimensiones y representa en la actualidad un desafío terapéutico.(1,2,3,4,5,6) El término de resistencia bacteriana, incluye toda la capacidad que tienen las bacterias de soportar los efectos de los antibióticos, es decir, la aparición de cepas refractarias al efecto bactericida o bacteriostático. De esta forma, los microorganismos pueden clasificarse en “resistentes” o “susceptibles” en función de la concentración mínima inhibitoria (CMI) que presenten frente a cada antibiótico como medida cuantitativa del grado de resistencia. Las cepas resistentes, son las que predominan por la presión selectiva de los antimicrobianos, proceso que se ve acelerado por el mal uso y el abuso de los antibióticos tanto en humanos como animales.(7,8,9,10,11,12,13,14)
La presencia de bacterias en el torrente circulatorio, con significancia clínica, es la responsable de una alta morbilidad y mortalidad, por tal motivo, la información precoz del resultado del hemocultivo le permite al clínico confirmar bacteriemia, así como la elección de fármacos de menor o mayor espectro, dosis adecuadas, cambio a tratamientos y una mejora del pronóstico con la finalidad de reducir la mortalidad del paciente con sepsis. Para ello, en la actualidad se buscan métodos que permitan disminuir los tiempos de emisión de resultados. Las infecciones neonatales despiertan una gran preocupación tanto en los familiares del recién nacido como en el personal de salud que lo atiende.(15,16,17,18,19,20) Esto se debe al grave pronóstico de algunas de ellas en relación con la supervivencia y a las posibles secuelas. Por tal motivo, las mismas son el objeto de estudio de numerosas investigaciones con miras a lograr su prevención y control.(21,22,23,24,25,26)
Las unidades de cuidados intensivos neonatales (UCINs), son servicios de atención especial en los hospitales pues, el recién nacido, tiene más riesgo de desarrollar infecciones diseminadas por ser más vulnerable inmunológicamente, por la utilización de medios diagnósticos invasivos a las que se somete al niño desde su nacimiento y por los reducidos esquemas de tratamiento antimicrobianos que se le aplican. A pesar de los avances en la terapia antibiótica, de las medidas de soporte y del conocimiento de los factores de riesgo infeccioso; la sepsis es todavía causa importante de morbilidad y mortalidad en las mismas.(27,28,29,30,31,32)
Estados Unidos por su parte, demostró que los microorganismos Gram positivos y los hongos fueron los responsables del mayor número de casos de sepsis y bacteriemia, mientras en Cuba, los servicios de neonatología revelaron que, de 368 aislamientos, 191 fueron Gram positivos (51,9 %) y solo 177 (48,1 %) de Gram negativos, así mismo las muestras biológicas de catéter, hemocultivo y secreción respiratoria, evidencian que los mayores porcientos de aislamientos se corresponden con Staphylococcus epidermidis, Staphylococcus aureus y Enterococos spp.(33,34,35,36,37,38)
Por lo tanto, es indispensable la existencia de un programa de vigilancia de la resistencia bacteriana, que posibilite la identificación de fenotipos de resistencia antimicrobiana de las bacterias que circulan en la unidad pediátrica y tengan en cuenta los patrones de susceptibilidad antimicrobiana de las mismas, lo cual permitiría para médicos y demás profesionales sanitarios una conciliación en la política de antibióticos a emplear, que posibilite el uso más racional de la quimioterapia antimicrobiana.(39,40,41,42,43,44,45)
MÉTODO
Se realizó un estudio observacional, descriptivo y transversal, con el objetivo de determinar los fenotipos de resistencia antimicrobiana de cocos Gram positivos aislados en hemocultivo de pacientes hospitalizados en el Hospital Docente Pediátrico “Pepe Portilla” de Pinar del Rio desde enero a junio 2021. El universo estuvo constituido por 433 pacientes comprendidos en edades pediátricas. Después de ser procesadas, las muestras quedaron conformadas por 44 hemocultivos que resultaron positivos a cocos Gram positivos. Se utilizó una ficha de recolección de datos confeccionada por los investigadores, además de la indicación médica del examen y los registros primarios del laboratorio de microbiología. Para la obtención y procesamiento de las muestras se entrevistó a los padres del paciente, se solicitó consentimiento informado para participar en la investigación. La toma de muestra microbiológica para los diferentes procedimientos diagnósticos, se realizó por un especialista del laboratorio de microbiología. En todos los casos se cumplieron los protocolos de asepsia y antisepsia recomendadas, así como el proceder de toma de muestra indicada para el sitio de aislamiento en estudio.
El área donde se realizó la toma la muestra de sangre para Hemocultivo, contó previamente con la limpieza con agua y jabón y luego solución antiséptica. Posteriormente se extrajeron 3 ml de sangre del paciente por venopunción y para llegar al diagnóstico microbiológico, se siguió la marcha técnica propuesta por un estudio que indico la inoculación en medios de cultivo específicos, su posterior incubación a 37ºC por un tiempo de hasta 7 días con siembras seriadas en agar chocolate a las 24, 72 horas y 7 días y finalmente la observación del crecimiento. Se comprobaron las características culturales del crecimiento y se procedió a realizar coloración de Gram para observar al microscopio óptico, las características morfológicas y tintoriales. Se escogieron los cultivos que se corresponden con los microorganismos en estudio y se procedió a su identificación según los procedimientos y normativas técnicas vigentes y las implementadas en los talleres nacionales de vigilancia de fenotipos resistentes. Además, se tuvo en cuenta suspender cualquier tratamiento con antibióticos 48 horas antes de la toma de muestra, para evitar reducción de la representación de microorganismos en los exámenes microscópicos y aislados en los cultivos.
Una vez realizada la toma de muestra, se identificaron todas las cepas sugestivas de cocos Gram positivos que aparecieron en el medio de cultivo Agar chocolate, se les realizó examen microscópico con tinción de Gram, seleccionando para la siguiente etapa de identificación los que tuvieron la siguiente morfología y carácter tintorial: cocos Gram Positivos agrupados en racimos, en cadenas o en duplas. Las colonias así obtenidas se subcultivaron en una cuña de agar nutriente o agar chocolate para su conservación y utilización posterior. El diagnostico microbiológico se realizó a través de lo referido por MacFaddin.
Finalmente, se realizó la determinación de la susceptibilidad antimicrobiana in vitro, para lo cual se utilizó la técnica de difusión en agar por diseminación superficial en placa (Bauer-Kirby) y su interpretación estuvo basada en las normas recomendadas por el CLSI así como el E-test de Vancomicina para determinar la susceptibilidad para este antibiótico, la cual se realizó mediante el método de difusión con discos en agar Muller-Hinton (o Agar sangre de carnero al 5 % para algunos estreptococos y enterococos). Su ensayo se basa en el enfrentamiento de un disco impregnado con el antibiótico en la superficie de un medio de cultivo (Mueller-Hinton) donde crece el microorganismo aislado. Este medio permite la difusión del antibiótico. Se observa que a medida que aumenta el radio de la difusión, hay una reducción logarítmica de la concentración del antibiótico hasta que se alcanza un punto en el cual el desarrollo bacteriano en la superficie del agar ya no es inhibido. El resultado indica una zona de inhibición del desarrollo del microorganismo con bordes bien delineados (halo de inhibición) el cual se mide con una regla milimétrica.
La Resistencia de los estafilococos a las penicilinas (penicilinasa) se detecta mediante la técnica de difusión con disco en agar y por e-test. Para la detección de cepas de estafilococos resistentes a la penicilina, se utiliza un disco de 10 unidades de penicilina. Así mismo, el disco de penicilina se debe utilizar para determinar la sensibilidad a todas las penicilinas lábiles a la acción de la penicilinasa, como ampicilina, amoxicilina, carbenicilina, ticarcilina, azlocilina, mezlocilina y piperacilina. Cuando el halo de inhibición con el disco de penicilina de 10 unidades es ≥ 29 mm se considera sensible, mientras que en presencia de una cepa SARM, si el halo de penicilina fue ≥ 29 mm con borde entero es resistente, sin embargo, si los bordes son deformes con igual diámetro, se da como sensible según el Edge- tests.
La Detección de los fenotipos SARM y SASM se realizó a través de la técnica de difusión con discos de oxacilina y cefoxitina, esta última se utiliza como marcador de resistencia mediada por el gen MecA, y que además es un inductor más potente de su sistema regulador, incrementando su expresión y permite una mejor detección de este mecanismo. Se colocó el disco de oxacilina y cefoxitina a una distancia entre disco de 20mm. Se consideró resistente a la oxacilina cuando el halo de inhibición de la oxacilina es <10 mm y en el caso del cefoxitin se dio como resistente cuando su halo de inhibición fue ≤ 21mm y sensible ≥ 22mm para Staphylococcus aureus y resistente ≥ de 25 mmm para Staphylococcus epidermidis.
Del mismo modo, aquellas cepas de Staphylococcus que sean resistentes a cefotixina en Staphylococcus aureus, indican la presencia del gen MecA y, por ende, implica tener resistencia a todos los antibióticos betalactámicos. Sin embargo, cuando una cepa de Staphylococcus aureus sea sensible a dicho compuesto, la cefoxitina, no hay presencia del gen MecA y con ello se descarta la resistencia a la meticilina.
Varias cepas de Staphylococcus aureus poseen resistencia borderline o también denominada resistencia de bajo nivel a la oxacilina. Estas son caracterizadas por presentar resistencia intermedia a la oxacilina. Las cepas borderline se clasifican en dos categorías en función de la presencia o de la ausencia del gen MecA. En el caso de que las cepas posean el gen MecA, estas son fuertemente heterorresistentes y productoras de la PBP2a. Por el contrario, aquellas cepas que no dispongan del gen MecA y, por ende, la PBP2a, presentan resistencia de bajo nivel como consecuencia de una hiperproducción de betalactamasa estafilocócica o también se puede deber a una modificación de las PBPs de tipo 1, 2 y 4, para el caso en particular de Staphylococcus aureus.
Se detectó BORSA (Staphylococcus borderline a la oxacillina) cuando el halo del cefoxitin fue ≥ 22 mm y dentro del halo de inhibición de la oxacilina presentó colonias. Es importante tener presente que a temperaturas superiores a 35ºC, los Staphylococcus pueden no presentar resistencia a meticilina.
La Resistencia a los macrólidos y lincosamidas (cMLSB, iMLSB Y MSB) se procedió de tal manera Los macrólidos, junto con las lincosamidas y las estreptograminas B (MLSB) son tres grupos de antimicrobianos de estructuras químicas diferentes, pero con mecanismos de acción similares. En los Staphylococcus, la resistencia a los macrólidos (eritromicina, claritromicina, azitromicina, midecamicina) puede asociarse a diferentes fenotipos de sensibilidad o de resistencia a las lincosamidas (clindamicina) que se pueden identificar en el laboratorio mediante el método de difusión con discos de eritromicina y clindamicina o mediante dilución en caldo utilizando una combinación de ambos antimicrobianos.
Los fenotipos que se observan mediante difusión con discos son:
1. Resistencia a la eritromicina y a la clindamicina.
2. Resistencia a la eritromicina y sensibilidad a la clindamicina, pero con un achatamiento del halo de la clindamicina en la proximidad de la eritromicina (Dtest positivo).
3. Resistencia a la eritromicina y sensibilidad a la clindamicina sin achatamiento del halo (D-test negativo). En el primer caso se trata de resistencia constitutiva a la eritromicina y a la clindamicina (fenotipo cMLSB), en el segundo de resistencia constitutiva de expresión inducible (fenotipo iMLSB) y en el tercero de resistencia a la eritromicina mediada por una bomba de expulsión activa (fenotipo MSB).
Se puede identificar también un cuarto fenotipo de resistencia a la clindamicina y sensibilidad a la eritromicina debido a la acción de enzimas que inactivan las lincosamidas (codificadas por los genes lnu) aunque es poco frecuente. La resistencia a los macrólidos y a la clindamicina es más frecuente entre cepas de Staphylococcus coagulasa negativo que en Staphylococcus aureus. La caracterización fenotípica de resistencia para macrólidos, lincosamidas y estreptograminas (M, eflujo y CMLSB ó iMLSB, metilación ribosomal constitutiva e inducible respectivamente) se hizo mediante el ensayo del doble disco (D test).
Para ello se emplearon discos de E (15 ug) y CD (2 ug) que se colocaron a una distancia de 15-26 mm y al realizar la lectura se detectan los siguientes parámetros:
· D- test positivo: cuando el halo de Eritromicina esta ≤ 13mm (resistente) y el halo de la clindamicina presenta un achatamiento en dirección al disco de eritromicina en forma de D estamos en presencia del fenotipo iMLSB (fenotipo de resistencia inducible).
· D-test negativo: cuando el halo de la clindamicina≥19mm sin achatamiento y el halo de eritromicina da resistencia. la eritromicina no induce la resistencia y por tanto no se observa un achatamiento en el halo de la clindamicina, antimicrobiano que conserva su actividad antibacteriana y es eficaz si se utiliza en el tratamiento
· cMLSB (fenotipo de resistencia constitutivo): es cuando la clindamicina y la eritromicina ambas son resistentes.
Los mecanismos de resistencia a los antimicrobianos del grupo MLSB que subyacen bajo los 4 fenotipos de resistencia anteriormente indicados pueden resumirse en:
· Modificación de la diana (ARNr 23S) por la acción de metilasas codificadas principalmente por genes erm (erythromycin ribosome methylase, ermA, ermB, ermC, entre otros) y en raras ocasiones por el gen cfr;
· Expulsión activa del antimicrobiano relacionado con diferentes genes de codificación plasmídica del tipo msra.
· Inactivación del antimicrobiano (genes de tipo lnu).
· Modificación de la diana por mutación del ARNr 23S y/o de proteínas ribosómicas.
La presencia de genes erm es el mecanismo más frecuente y confiere un fenotipo de resistencia denominado MLSB (resistencia a los macrólidos de 14, 15 y 16 átomos de carbono, las lincosamidas y las estreptograminas del grupo B). Como se indicó anteriormente, este fenotipo puede ser de expresión constitutiva o inducible (cMLSB o iMLSB). En el primer caso se produce resistencia cruzada de alto nivel a todos los antimicrobianos del grupo MLSB, mientras que el fenotipo inducible se presenta como resistencia a los macrólidos, pero sensibilidad a las lincosamidas y a las estreptograminas B en ausencia de un inductor.
En las cepas con fenotipo MLSBi, la eritromicina induce la expresión del mecanismo de resistencia. Por ello, si se estudia la sensibilidad de estas cepas a los macrólidos de 16 átomos de carbono, la clindamicina y las estreptograminas del grupo B en ausencia de eritromicina, se manifestarán como sensibles a estos antimicrobianos, cuando en realidad son resistentes, ya que poseen el mecanismo de resistencia que se puede inducir in vivo y conducir a fracasos terapéuticos. Cuando se produce una metilación de la diana por la metilasa codificada por el gen cfr se produce resistencia combinada a la clindamicina, al cloranfenicol y florfenicol, a las oxazolidinonas (linezolid), a pleuromutilinas y a estreptograminas A. El método más adecuado para detectar la resistencia al linezolid es el de microdilución. Los resultados de CMI obtenidos por Etest son generalmente más bajos, principalmente cuando la resistencia está mediada por el gen cfr y las CMIs pueden ser tan bajas como 1 o 2 mg/L (sensibles). El método de difusión con discos tampoco detecta adecuadamente la resistencia al linezolid, aunque es detectable este fenotipo de resistencia cuando el halo de inhibición es menor o igual a 20mm, excepto en los casos con alto nivel de resistencia (CMI >32 mg/L).
En relación a la Sensibilidad disminuida a los glucopéptido, los estafilococos en general mantienen una elevada sensibilidad a los glucopéptidos, de manera que lo más frecuente es que sean sensibles a la vancomicina y a la teicoplanina. Sin embargo, existen cepas con sensibilidad disminuida a ambos antimicrobianos, tanto entre Staphylococcus aureus s como entre las diferentes especies de Staphylococcus coagulasa negativa . En el caso de Staphylococcus aureus, actualmente se define una cepa como VISA (vancomycin intermediate Staphylococcus aureus) cuando la CMI de vancomicina frente a esta cepa, determinada por el método de microdilución en caldo es de 4-8 mg/L según los criterios del Clinical and Laboratory Standards Institute (CLSI).
En el caso de Staphylococcus coaguasa negativa se considera una cepa con sensibilidad intermedia a la vancomicina (CLSI) cuando los valores de CMI son de 8-16 mg/L y resistente cuando la CMI es ≥ 32 mg/L. realizamos la aplicación del E-test de Vancomicina para determinar la susceptibilidad para este antibiótico. La prueba se basó en el uso de tiras de epsilometros conformados por un soporte de 5x150 mm, el cual contiene un gradiente exponencial continuo de antibióticos inmovilizados en uno de sus lados y una escala interpretativa en el otro.
El gradiente de antibiótico cumple un rango de concentración correspondiente aproximadamente a 20 diluciones doble de CIM. Estas concentraciones están diseñadas para corresponder con los rangos de CIM. Se aprecia una zona elíptica, la concentración mínima del antibiótico se determina en la escala, en el punto en el cual el crecimiento se hace más difuso o se inhibe ofreciendo una lectura más precisa que las lecturas en logaritmos de los métodos tradicionales debido al amplio rango de CIM y los intervalos de concentración de los antibióticos impresos en la escala.
La resistencia a la Rifampicina se determinó mediante la colocación del e-test del mismo nombre sobre la superficie de Agar de Muller-Hinton previamente inoculado con la cepa a testar de la forma ya descrita anteriormente y basándonos en los criterios de sensibilidad o resistencia para el fármaco de acuerdo a CLSI.
La Resistencia de los Enterococcus a los glucopeptidos en este caso se determinó la resistencia a la vancomicina, se han descrito seis fenotipos diferentes (VanA, VanB, VanD, VanE, VanG, y VanL) mediados por los cluster de genes de resistencia vanA, vanB, vanD, vanE, vanG, y vanL respectivamente. Los fenotipos VanA y VanB son los más frecuentes, mientras que VanD, VanE, VanG y VanL, son infrecuentes. Los métodos fenotípicos que se emplean para detectar la resistencia a glucopéptidos en enterococos incluyen la determinación de las CMIs de vancomicina y de teicoplanina mediante métodos de dilución o mediante Etest. Para ello se utiliza el medio Mueller Hinton suplementado con cationes (Ca+2 y Mg+2), un inóculo estándar (0,5 de la escala McFarland) e incubación de 24 h a 35 ± 2 °C.
Teniendo en cuenta los valores estándares de CLSI se consideran resistentes valores de CMI mayor o igual a 32 mg/l y sensible si es menos o igual a 4 mg/l. La susceptibilidad de aminoglucosidos, quinolonas y sulfas y otros grupos de antimicrobianos fueron determinados de acuerdo al protocolo CLSI.
La Resistencia del Streptococcus pneumoniae a los betalactámicos se debe a cambios estructurales en las dianas, las proteínas fijadoras de penicilina (penicillin-binding proteins, PBPs). Las principales PBPs implicadas en la resistencia a los betalactámicos son las PBP 1a, 2b y 2x. Los genes que las codifican tienen una estructura en mosaico, ya que una parte de ellos ha sido reemplazada por variantes alélicas de genes de otras cepas de Streptococcus pneumoniae o de Streptococcus del grupo viridans.
La resistencia a la penicilina ocurre de manera gradual, de forma que la acumulación de cambios en diferentes dianas confiere valores más altos de CMIs de los betalactámicos. Las alteraciones en las PBPs 2b y 2x confieren resistencia de bajo nivel a la penicilina. Los cambios en la PBP 1a confieren resistencia de alto nivel a la penicilina en aquellos aislamientos que tienen alterada la PBP 2x o las dos (PBP 2b y PBP 2x). Las cefalosporinas de tercera generación no se unen a la PBP 2b por lo que la resistencia a estos compuestos se debe a cambios en las PBPs 2x y 1a. Los neumococos resistentes a la penicilina presentan menor afinidad por los otros antimicrobianos betalactámicos.
Las cepas con CMI de penicilina ≥ 0,12 mg/L se asocian a fracasos en el tratamiento de la meningitis neumocócica ya que los niveles alcanzados en líquido cefalorraquídeo con dosis estándar de penicilina son bajos. Por este motivo, el CLSI estableció los puntos de corte considerados “clásicos” para la penicilina (sensible ≤ 0,06 mg/ml, resistencia intermedia 0,12-1 mg/L y resistente ≥ 2. Sin embargo, la neumonía y otras infecciones no-meníngeas causadas por aislamientos con CMI de penicilina entre 0,12 y 2 mg/L se pueden tratar con éxito con penicilina parenteral, amoxicilina o cefalosporinas.Las cepas sensibles a la penicilina (≤ 0,06 mg/L) lo son también al resto de los antimicrobianos betalactámicos utilizados en el tratamiento de la infección neumocócica. La utilización de los discos de penicilina (10 U) está totalmente desaconsejada para determinar la sensibilidad de Streptococcus pneumoniae frente a este antimicrobiano. La utilización de discos de cefotaxima, ceftriaxona o cefepima también está desaconsejada. El cribado por difusión con discos de oxacilina (1µg) se considera el mejor método para detectar las CMIs de penicilina con valores superiores a 0,06 mg/L. La sensibilidad a la oxacilina implica sensibilidad a todos los betalactámicos.
La Resistencia del Streptococcus pneumoniae a las fluoroquinolonas (Ciprofloxacino).
El principal mecanismo de resistencia a fluoroquinolonas en Streptococcus pneumoniae es debido a las mutaciones en las regiones determinantes de resistencia a quinolonas (QrDr) tanto de la ADN topoisomerasa IV (ParC y ParE) que es la diana primaria, como de la ADN girasa (GyrA y GyrB) que es la diana secundaria. La resistencia también puede adquirirse por recombinación interespecies con estreptococos del grupo mitis, sin embargo, este mecanismo es poco frecuente.
Por otro lado, el Comité de l’Antibiogramme de la Société Française de Microbiologie (SFM, 2010) recomienda la utilización de discos de norfloxacino (5 µg) como método de cribado para detectar cepas de neumococo con mutaciones de primer nivel, utilizando como punto de corte de resistencia a aquellos halos de <10 mm. En nuestra experiencia, utilizando estos discos de norfloxacino el punto de corte de <10 mm tiene una sensibilidad superior al 97 % y una especificidad del 88 % para la detección de cepas con mutaciones que confieren resistencia a las fluoroquinolonas.El cribado inicial de cepas con mutaciones de primer nivel que confieren bajo nivel de resistencia a las fluoroquinolonas puede hacerse fácilmente por la técnica de difusión con disco. El medio utilizado es el agar Mueller-Hinton con 5 % de sangre de carnero y se requiere una incubación de 20-24 h en atmósfera enriquecida con 5 % de CO2. Esta técnica puede realizarse directamente a partir de las botellas de hemocultivo con crecimiento positivo en las que se sospeche la presencia de Streptococcus pneumoniae. El principal inconveniente es la posibilidad de obtener falsa resistencia (halos inferiores a 10 mm) en aquellas cepas con fenotipo mucoso como son las del serotipo 3. Según CLSI con el uso de discos de Levofloxacino se considera sensible con halos mayor o igual a 8 mm y resistente con halos menor o igual a 2mm.
A los hemocultivos positivos en los que se aislaron Cocos Gram positivos se les determinó fenotipos de resistencia SARM, SASM, BORSA, iMLSB, cMLSB,MSB a los macrolidos y clindamicina, penicilinasas, sensibilidad disminuida a la Vancomicina, resistencia a la Rifampicina, resistencia a Linezolid, resistencia a Fluoroquinolonas (posible fenotipo QrDr).
Aspectos éticos la investigación
El estudio se enmarcó dentro de los principios de la ética médica profesional. La información se conoció de forma resumida y con fines investigativos. Para el desarrollo de la investigación se realizaron intervenciones técnicas propias de los estudios para clínicos normalmente realizados a los pacientes, en donde se sospecha la presencia de una infección de cualquier tipo, bien estandarizadas dentro de los procedimientos de un Laboratorio de Microbiología, por lo que no constituyo ningún daño a personas, familiares, ni la institución, sustentado en los principios estipulados por el comité de ética médica.
Procesamiento estadístico
El análisis y registro de la información de las variables se realizó un estudio descriptivo través de la distribución de frecuencias absolutas y relativas. Se empleó la prueba de independencia basada en la distribución de Chi cuadrado, tomando en cuenta un nivel de significación (α)= 0,05, en la determinación de número (n°) y porcentaje (%) de cepas resistentes a los antimicrobianos, se utilizó el programa WhonetTM Versión 5,6 (Word Health Organization). Además, se construyeron tablas y gráficos estadísticos para una mejor ilustración e interpretación de los resultados a partir de las salidas generadas por el programa Statistical Package for Social Sciences (SPSS) versión 26.0
Aspectos de Bioseguridad
La investigación fue enmarcada dentro de los principios contenidos en el Programa Provincial de Medio Ambiente y Desarrollo, sustentada en la legislación ambiental vigente cuya expresión más reciente lo constituye la Ley No.81 de Medio Ambiente, y en materia de Bioseguridad, el Decreto Ley 190, el cual integra los principios que rigen las normas básicas para el trabajo e incluye las buenas prácticas del laboratorio: El uso de los medios de protección individual y colectiva, el tratamiento correcto de desechos biológicos peligrosos y el suplemento de las normas de esterilización y desinfección.
RESULTADOS
La finalidad buscada para la presente investigación consiste en la exposición de información detallada y analizada a partir de 433 pacientes del estudio realizado, de los cuales solo 44 resultaron con hemocultivos positivos a cocos Gram positivos. Los resultados expresan el cumplimiento de los objetivos establecidos quedando expuestos en tablas y figuras.
|
Tabla 1. Frecuencia de microorganismos aislados de hemocultivos |
||
|
No |
% |
|
|
Staphylococcus aureus |
7 |
15,9 |
|
Staphylococcus epidermidis |
34 |
77,3 |
|
1 |
2,3 |
|
|
Enterococos spp |
2 |
4,5 |
|
Nota: (n = 44) |
||
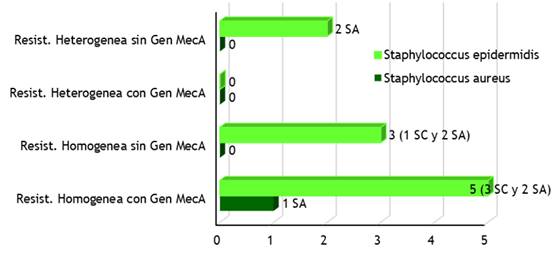
Figura 1. Fenotipos de resistencia bordeline a oxacilina en el género Staphylococcus según servicios de hospitalización
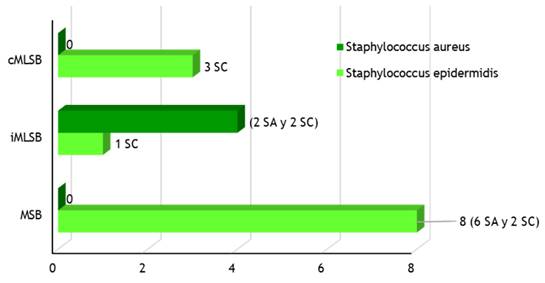
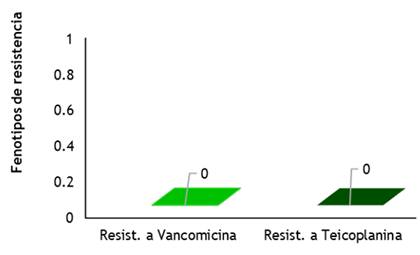
Figura 3. Fenotipos de resistencia a Enterococcus spp. según servicios de hospitalización
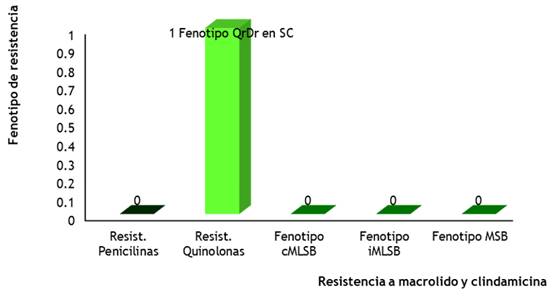
Figura 4. Fenotipos de resistencia de Streptococcus pneumoniae según servicios de hospitalización
DISCUSIÓN
La tabla 1 muestra que Staphylococcus epidermidis resultó el de mayor frecuencia con un 77,3 % en los aislados de hemocultivos, seguidos del 15,9 % de Staphylococcus aureus, mientras las frecuencias más bajas se presentaron para Enterococcus spp. y Streptococcus pneumoniae. Datos basados de estudios epidemiológicos procedentes de redes de vigilancia en países desarrollados, entre ellos los Estados Unidos, muestran que hasta 60 % de las infecciones del torrente sanguíneo son causadas por este grupo de gérmenes, y que la seguridad terapéutica de los esquemas de antibióticos disponibles se ve amenazada por la emergencia de cepas resistentes, las cuales muestran un incremento progresivo con el paso de los años.(46,47,48,49,50,51)
Resultados similares a los encontrados en este estudio fueron presentados por un estudio donde se agregó que dentro de las bacterias Gram positivas, los Staphylococcus aureus, Staphylococcus epidermidis y Enterococcus spp., representan los patógenos de mayor importancia en el medio ambiente hospitalario. Así mismo una investigación reporto que el Staphylococcus epidermidis fue el microorganismo más frecuente con 42 aislamientos, representando el 11,0 %.(52,53,54,55,56,57,58)
Investigaciones realizadas en Argentina también coinciden con este estudio, a partir de los mayores reportes de aislamiento de Staphylococcus epidermidis y Enterococos spp. como patógenos Gram positivos causantes de sepsis neonatal y de bacteriemia. Por su parte diversos estudios señalan, que el Staphylococcus epidermidis hoy en día constituye el microorganismo más frecuente en los servicios de neonatología, así como en los diversos departamentos de los hospitales pediátricos, lo cual sugiere el establecimiento de estrategia de control. Otros reportes como los del hospital del estado Zulia, muestran una baja incidencia de microorganismos principalmente del género Enterococcus spp. en hemocultivos procesados con una reducción de 9,06 % en el año 2008 a un 4 % durante los años subsiguientes, siendo el Enterococcus faecium la especie más aislada (57,9 % del total de aislamientos del género), seguida por Enterococcus faecalis (37,7 %).(59,60,61,62,63,64,65)
La figura 1 representa los fenotipos de resistencia borderline a Oxacilina de los Staphylococcus aureus y Staphylococcus epidermidis aislados en muestras de hemocultivos, estos últimos con una mayor resistencia homogénea con gen MecA en cinco microorganismos, de ellos 3 en servicios cerrados y dos en servicios abiertos, seguido de la resistencia homogénea sin Gen MecA con tres microorganismos distribuidos, uno en servicio cerrado y dos en servicio abierto, otros dos con resistencia heterogénea sin Gen MecA.(66,67,68,69,70,71)
Esta mayor resistencia del Staphylococcus aureus con un fenotipo de resistencia homogénea con Gen MecA en comparación con el Staphylococcus epidermidis se debe a la adquisición del ADN exógeno (gen MecA) que codifica la proteína fijadora de penicilina (PBP) PBP2a, que posee baja afinidad por los betalactámicos. Sin embargo, para el caso del Staphylococcus aureus, solo se evidenció una mayor resistencia homogénea con Gen MecA, no así para los restantes patrones de resistencia homogénea o heterogenea.(72,73,74,75,76,77,78)
Según los estudios, la mayoría de los aislamientos clínicos presentan un patrón de heterorresistencia bajo las condiciones rutinarias de cultivo, resultados que no coinciden con los encontrados en este análisis. Sin embargo, cabe aclarar, que las cepas heterogéneas pueden aparecer como homogéneas bajo ciertas condiciones, como el crecimiento en un medio hipertónico (suplementado con 2 % de NaCl) o la incubación a 30ºC. Estos cambios en la expresión de la resistencia bajo diferentes condiciones de cultivo son transitorios y fenotípicos. Las cepas con heterorresistencia suelen mostrarse como sensibles a muchos betalactámicos cuando se realiza un antibiograma con discos y su interpretación como sensibles puede conducir a fracasos terapéuticos. Las cepas con resistencia homogénea a la oxacilina presentan alto nivel de resistencia cruzada a todos los betalactámicos incluyendo las penicilinas, las cefalosporinas, las carbapenemas y las monobactamas.(79,80,81,82,83,84,85,86)
Por otra parte, en Staphylococcus la resistencia a la oxacilina implica resistencia al resto de los betalactámicos, tanto si presentan homorresistencia como heterorresistencia. En España en los últimos 10 años, la prevalencia de resistencia a la meticilina en Staphylococcus aureus (SARM) se ha mantenido en torno al 30 %, mientras que globalmente, entre las diferentes especies de Staphylococcus coagulasa negativo, las cifras oscilan entre el 60-70 % en este mismo periodo y en general estos porcentajes son superiores en cepas procedentes de unidades de cuidados intensivos. Otros estudios han concluido que la expresión fenotípica de la resistencia mediada por el gen MecA es compleja y se afecta por diferentes factores como la temperatura, el pH, la osmolaridad, la presencia de secuencias cromosómicas reguladoras y de otros genes cromosómicos no relacionados. En las cepas que presentan resistencia homogénea o de alto nivel a la oxacilina, la mayor parte de la población expresa la resistencia. Sin embargo, la expresión fenotípica de la resistencia a la meticilina generalmente es heterogénea. Las cepas con expresión heterogénea se caracterizan porque sólo una pequeña proporción de la población (≤0,1 %) sobrevive con concentraciones de oxacilina superiores a 10 mg/L, mientras que la mayor parte de la población no es viable con bajas concentraciones del antimicrobiano (1-5 mg/L).(87,88,89,90,91,92)
En función de la presencia o ausencia del gen MecA: si poseen el gen MecA son cepas heterorresistentes que producen la PBP2a. Si no contienen el gen MecA, ni por tanto la PBP2a, esta resistencia de bajo nivel puede deberse a la hiperproducción de la betalactamasa estafilocócica o a la modificación (hiperproducción o alteración) de las PBP 1, 2, y 4. Las cepas que hiperproducen betalactamasa son sensibles a las asociaciones de betalactámico con inhibidor de betalactamasa (ácido clavulánico, tazobactam y sulbactam).(93,94,95)
La figura 2 muestra los fenotipos de resistencia a macrólidos y clindamicina para los Staphylococcus epidermidis con predominio del fenotipo MSB con ocho microorganismos (resistencia a eritromicina y sensibilidad a clindamicina), de ellos 6 en servicios abiertos y 2 en servicios cerrados, seguido por el fenotipo cMLSB (resistencia constitutiva a eritromicina y clindamicina) con tres microorganismos, todos en servicios cerrados y por último, el fenotipo iMLSB con un microorganismo en sistema cerrado. Sin embargo, aunque el fenotipo más encontrado en este estudio no fue el iMLSB, cabe señalar que su presencia es sinónimo de resistencia inducida, de ahí su gran importancia, ya que se expresa precisamente durante el tratamiento e induce el fallo del mismo por tanto el fracaso terapéutico y la complicación del paciente.(96,97,98,99)
Así mismo, la aparición de aislados con resistencia inducible a la clindamicina (iMLSB) origina un serio problema que se ha incrementado en los últimos años., de ahí que la importancia de este fenotipo de resistencia se deba a que los aislados con resistencia inducible a la clindamicina aparentan una susceptibilidad in vitro a ella, pero cuando este antibiótico es usado clínicamente ocurre in vivo la inducción de la resistencia, con el consiguiente fracaso terapéutico Patel et al 2006. Por tal razón, todos los laboratorios deberían implementar la técnica de difusión de doble disco (prueba D), estandarizada por el CLSI, para detectar este tipo de resistencia. Por su parte, la menor frecuencia para este tipo de resistencia (iMLSB) encontrado en este estudio, coincide con los reportados por varias investigaciones donde se habla de frecuencias relativamente bajas para la resistencia inducible a la clindamicina (1,33 %, 1,39 %, 4,0 % y 1,2 %, respectivamente).(10,101,102)
Otros trabajos referidos a resistencia a los macrólidos y a la clindamicina, muestran una mayor frecuencia con estos fenotipos de resistencia a cepas de Staphylococcus epidermidis con respecto a Staphylococcus aureus, resultados que concuerdan con los obtenidos. De esta forma los datos del sexto estudio nacional de estafilococos realizado en 2006 confirman que los porcentajes de resistencia de Staphylococus aureus a la eritromicina y a la clindamicina fueron del 37 % y del 19,9 %, respectivamente, muy inferior al de Staphylococcus epidermidis.
Según la literatura, en los Staphylococcus se han reportado hasta un cuarto fenotipo de resistencia a la clindamicina con sensibilidad a la eritromicina y a la estreptogramina B, poco frecuente y no encontrado en este estudio, dado por la acción de enzimas (codificadas por los genes lnu) que inactivan exclusivamente a las lincosamidas.
Por otra parte, la presencia de genes erm es el mecanismo más frecuente y confiere un fenotipo de resistencia denominado MLSB (resistencia a los macrólidos de 14, 15 y 16 átomos de carbono, las lincosamidas y las estreptograminas del grupo B). Como se indicó anteriormente, este fenotipo puede ser de expresión constitutiva o inducible (cMLSB o iMLSB). En el primer caso se produce resistencia cruzada de alto nivel a todos los antimicrobianos del grupo MLSB, mientras que el fenotipo inducible se presenta como resistencia a los macrólidos, pero sensibilidad a las lincosamidas y a las estreptograminas B en ausencia de un inductor. En las cepas con fenotipo iMLSB, la eritromicina induce la expresión del mecanismo de resistencia.
La figura 3 evidencia que para los Enterococcus spp. no se encontró resistencia a la vancomicina, ni teicoplanina en los aislados en hemocultivos de pacientes pediátricos, sin embargo, la literatura recoge datos importantes y preocupantes acerca de la creciente resistencia de Entorococcus spp. a los glucopéptidos como Vancomicina.(103)
Estudios relacionados muestran que los enterococos poseen resistencia intrínseca de bajo nivel a los aminoglucósidos y la adquisición de determinantes genéticos asociados a la producción de enzimas modificadoras de aminoglucósidos conllevan a la expresión de altos niveles de resistencia a dichos compuestos, así mismo sucede con la resistencia de enterococos a los glucopéptidos como la vancomicina y teicoplanina, algo que es muy peligroso y actualmente se vigila epidemiológicamente.
La figura 4 muestra los fenotipos de resistencia de Streptococcus pneumoniae según servicios de hospitalización. Solo se encontró un fenotipo QrDr (resistencia a quinolonas en servicios cerrados), no así para los restantes patrones, sin embargo, aunque en este estudio no se mostró el patrón de resistencia a las penicilinas, la mayoría de los trabajos evidencian un comportamiento diferente. Otros estudios demuestran que las cepas resistentes a la penicilina se presentan, con mayor frecuencia que las cepas sensibles, y también se presentan resistencia a otros grupos de antibióticos como la eritromicina, la tetraciclina, el cloranfenicol y el cotrimoxazol. La resistencia de Streptococcus pneumoniae a la penicilina y la sensibilidad disminuida a otros betalactámicos como las cefalosporinas de tercera generación se deben a cambios estructurales en las dianas de acción de estos compuestos, es decir, en las penicillin binding proteins (PBP, ‘proteínas fijadoras de penicilina’). sensibilidad disminuida a otros betalactámicos como las cefalosporinas de tercera generación se deben a cambios estructurales en las dianas de acción de estos compuestos, es decir, en las penicillin binding proteins (PBP, ‘proteínas fijadoras de penicilina’).
Cabe agregar que al igual que en otros países, la resistencia de Streptococcus pneumoniae a ciprofloxacino fue inferior al 5 % y existen evidencias que la mayor resistencia se presenta en pacientes mayores de 65 años, con enfermedad pulmonar obstructiva crónica (EPOC) y que han recibido tratamientos previos con fluoroquinolonas. Además, el principal mecanismo de resistencia a fluoroquinolonas en Streptococcus pneumoniae es debido a las mutaciones en las regiones determinantes de resistencia a quinolonas (QrDr) tanto de la ADN topoisomerasa IV (ParC y ParE) que es la diana primaria, como de la ADN girasa (GyrA y GyrB) que es la diana secundaria.
La resistencia también puede adquirirse por recombinación interespecies con estreptococos del grupo mitis, sin embargo, este mecanismo es poco frecuente. Esta versatilidad adaptativa del Streptococcus pneumoniae, le ha permitido crear mecanismos capaces de sobreponerse a las agresiones terapéuticas con un grado variable de eficacia. La resistencia a la penicilina tiene una mayor prevalencia en la población pediátrica. Esta resistencia se debe a modificaciones en las PBPs (Penicilin Binding Proteins), siendo las más afectadas 1a, 2a, 2b y 2x, donde se adquiere material genético de otras bacterias con las que coexiste íntimamente, como son los estreptococos del grupo viridans de la nasofaringe.
1. Más de la mitad de los cocos Gram positivos aislados en hemocultivos de pacientes pediátricos pertenecieron al género Staphylococcus.
2. Se evidenció la alta susceptibilidad de cocos Gram positivos a antibióticos como vancomicina, linezolid y teicoplanina y en contraposición la susceptibilidad disminuida de forma general a penicilinas y cefalosporinas.
3. Los fenotipos de resistencia encontrados con más frecuencia fueron: Penicilinasa y resistencia a macrólidos y clindamicina, siendo más frecuentes en pacientes internados en servicios cerrados de hospitalización.
REFERENCIAS BIBLIOGRÁFICAS
1. Álvarez-Hernández DA, Garza-Mayén GS, Vázquez-López R. Quinolonas: Perspectivas actuales y mecanismos de resistencia. Rev Chil Infectología [Internet]. 2015;32(5):499-504. Disponible en: https://scielo.conicyt.cl/scielo.php?script=sci_arttext&pid=S0716-10182015000600002&lng=en&nrm=iso&tlng=en DOI: 10.4067/S0716-10182015000600002 PMID 26633105 SciELO Lilacs Google Académico Microsoft Académico.
2. Araneo J, Escudero FI, Arbizu MAM, Trivarelli CB, Dooren MCVD, Lichtensztejn M, et al. Wellness and Integrative Health Education Campaign by undergraduate students in Music Therapy. Community and Interculturality in Dialogue 2024;4:117–117. https://doi.org/10.56294/cid2024117.
3. Ardanuy Carmen., Cercenado Emilia., Morosini María Isabel y Torres Carmen. Detección fenotípica de mecanismos de resistencia en grampositivos. Recomendaciones de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica. 2011.Procedimientos en Microbiología Clínica
4. Ardiles-Irarrázabal R-A, Pérez-Díaz P, Pérez-González J-C, Valencia-Contrera M. Trait emotional intelligence as a damping factor in the face of post-pandemic lockdown academic exhaustion? Salud, Ciencia y Tecnología 2024;4:787–787. https://doi.org/10.56294/saludcyt2024787.
5. Auza-Santiváñez JC, Díaz JAC, Cruz OAV, Robles-Nina SM, Escalante CS, Huanca BA. Gamification in personal health management: a focus on mobile apps. Gamification and Augmented Reality 2024;2:31–31. https://doi.org/10.56294/gr202431.
6. Ballesté López I, González Ballesté M, Campo González A, Amador Morán R, Pérez Hernández B, Díaz Valdés YN. Resistencia de Staphylococcus aureus frente a cefalosporinas en la sepsis neonatal y puerperal. Rev Cuba Obstetr Ginecol [Internet]. 2019 [citado 8 Jun 2021];, 45(1):[aprox. 0 p.]. Disponible en: http://revginecobstetricia.sld.cu/index.php/gin/article/view/416
7. Bantar C, Curcio D, Jasovich A, Bagnulo H, Arango A, Bavestrello L. Neumonía aguda adquirida en la comunidad en adultos: Actualización de los lineamientos para el tratamiento antimicrobiano inicial basada en la evidencia local del Grupo de Trabajo de Sudamérica (ConsenSur II). Rev. Chil. Infectol 2010; 27: 9-38.
8. Barreales A, Lara M, Hernández I, Díez O. 2011. Rapid identification and susceptibility testing of Gram-positive cocci in BacT/ALERT blood cultures by direct inoculation into the Vitek 2 system. Rev Esp Quimioter; 24:131-5
9. Bearman GM, Wenzel RP. 2005. Bacteremias: a leading cause of death. Arch Med Res; 36: 646–59
10. Begué Nuris., Goide, E., Frías, N., Domínguez, D., Leyva, R. 2015. Caracterización clínico epidemiológica de las infecciones asociadas a la atención sanitaria en niños y adolescentes. MEDISAN [revista en la Internet]. Ene [citado 2015 Oct 29]; 19(1): 4-9. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1029-30192015000100002&lng=es
11. Beltrán Marcelo A, García Del Corro Horacio J, Couso Mónica, Gallo María D, Lettieri Antonio, Barna Patricia V. Relación entre hacinamiento e infecciones comunitarias de piel y partes blandas. Medicina (B. Aires) [Internet]. 2017 dic [citado 2021 Nov 12]; 77(6): 465-468. Disponible en: http://www.scielo.org.ar/scielo.php?script=sci_arttext&pid=S0025-76802017000600003&lng=es
12. Blanco, M., Scandizzo, E y González Y. 2011. Frecuencia de aislamientos microbiológicos en hemocultivos. RC HC. 10: 8-13
13. Bravo Laura y Jiménez, V. 2018. Resistencia antibiótica en Pseudomonas aeruginosa: situación epidemiológica en España y alternativas de tratamiento. Trabajo fin de grado. Facultad de Farmacia. Universidad Complutense. 23 p
14. Briceño Indira, Suárez Manuel E. 2006. Resistencia Bacteriana en la Unidad de Cuidados Intensivos del Hospital Universitario de Los Andes. Medicrit 2006 [Citado 2021 Oct 12]; 3(2) Disponible en: http://www.medicrit.com/Revista/v3n2.06/30030206.pdf
15. Cancino V, Garzon ML, Hansen A, Brusca maria I. Evaluation of the preference and recommendation of dentists regarding the use of bamboo toothbrushes. Odontologia (Montevideo) 2024;2:125–125. https://doi.org/10.62486/agodonto2024125.
16. Cancino V, Monteagudo A, Brusca MI, Baggini E, Ferreira AV. Assessment of the level of knowledge in dentists about the benefits of bamboo toothbrushes compared to conventional plastic ones. AG Salud 2024;2:121–121. https://doi.org/10.62486/agsalud2024121.
17. Cano AMC. The gentrification of health: an analysis of its convergence. Gentrification 2024;2:54–54. https://doi.org/10.62486/gen202454.
18. Cano CAG, Castillo VS. Scholarly Output on Computer Networks and Communication: A Ten-Year Bibliometric Analysis in Scopus (2013-2022). Gamification and Augmented Reality 2024;2:29–29. https://doi.org/10.56294/gr202429.
19. Caquimbo GA, Virgilito A, Saldaña J. Functional aesthetic rehabilitation and its impact on self-esteem. Odontologia (Montevideo) 2024;2:126–126. https://doi.org/10.62486/agodonto2024126.
20. Caro SB, García M. Symbols in the field: a semiotic analysis of the football shields of bolívar city, colombia. Community and Interculturality in Dialogue 2024;4:138–138. https://doi.org/10.56294/cid2024138.
21. Castellano González MJ, Perozo-Mena AJ. Mecanismos de resistencia a antibióticos ƒÀ-lactamicos en Staphylococcus aureus. Kasmera [serie en Internet]. 2010 Jun [citado 01 agosto 2021]; 38(1): [aprox 12 páginas]. Disponible en: http://www.scielo.org.ve/scielo.php?script=sci_arttext&pid=S0075-52222010000100003&lng=es
22. Céspedes-Proenza I, La-O-Rojas Y, García-Bacallao Y, Leyva-Samuel L, Padín-Gámez Y, Crispin-Rodríguez D. Educational intervention on oral cancer in high-risk patients over 35 years of age. Community and Interculturality in Dialogue 2024;4:127–127. https://doi.org/10.56294/cid2024127.
23. Claudio BAM. Application of Data Mining for the Prediction of Academic Performance in University Engineering Students at the National Autonomous University of Mexico, 2022. LatIA 2024;2:14–14. https://doi.org/10.62486/latia202414.
24. Clinical and Laboratory Standards Institute. Performance Standards for Antimicrobial Susceptibility Testing; Twenty-Fifth Informational Supplement. CLSI document M100-S25. Pensilvania, Estados Unidos: Clinical and Laboratory Standards Institute; 2015.
25. Collazos JV. The management of human talent in the new business landscape, from the analysis of strategies for recruitment, selection, and development. SCT Proceedings in Interdisciplinary Insights and Innovations 2024;2:238–238. https://doi.org/10.56294/piii2024238.
26. Chow JW. Aminoglycoside resistance in enterococci. Clin Infect Dis.2000;31:586–9
27. Del Castillo Martín F. Neumococo resistente a la penicilina. Un grave problema de salud pública. An Esp Pediatr 1996; 45:233-35.
28. Demianchuk A, Hrymskyy V, Tsyhanyk M, Tymkiv B, Pidkova I. Analysis of scientific research on the sacred art of the Roman Catholic Church in Ukrainian territories. Salud, Ciencia y Tecnología - Serie de Conferencias 2024;3:.1234-.1234. https://doi.org/10.56294/sctconf2024.1234.
29. Duquesne Alderete Amilcar, Castro Sánchez Niria, Monzote López Alexis, Paredes Cuervo Issax. Caracterización de aislamientos de Staphylococcus aureus comunitarios en muestras purulentas. Rev cubana Med Gen Integr [Internet]. 2015 Sep [citado 2021 Nov 21]; 31(3). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0864-21252015000300004&lng=es.
30. Durich, J. O. 2000. Resistencia bacteriana a los antibióticos. Med. Integr., vol. 36, pp. 367–370
31. Espinosa, C., Cortés, J., Castillo, J y Leal, A.L. 2011. Revisión sistemática de la resistencia antimicrobiana en cocos Gram positivos intrahospitalarios en Colombia. Biomédica. 31: 27-34
32. Espinosa-Jaramillo MT. Internal Control in Companies from the Perspective of the COSO. Management (Montevideo) 2024;2:28–28. https://doi.org/10.62486/agma202428.
33. European Agency for the Evaluation of Medicinal Products Veterinary Medicines Evaluation Unit. 1999. Antibiotic Resistance in the European Union Associated with Therapeutic Use of Veterinary Medicines. Rep. Qual. Risk Assess. by Comm. Vet. Med. Prod., no. July, p. 34.
34. Ezelarab HAA, Abbas SH, Hassan HA, Abuo-Rahma GE-DA. Recent updates of fluoroquinolones as antibacterial agents. Arch Pharm (Weinheim) [Internet]. 1 de septiembre de 2018. 351 (9): 1800141. Disponible en: https://doi.org/10.1002/ardp.201800141 DOI: 10.1002/ardp.201800141 PMID 30048015 Google Académico Microsoft Académico
35. Ftaikhan AK, Al-Sharrad MA. Effect of Compaction Pressure on a Stabilized Rammed Earth Behavior. Salud, Ciencia y Tecnología - Serie de Conferencias 2024;3:821–821. https://doi.org/10.56294/sctconf2024821.
36. GONG, Zongrong et al. Portación nasal de Staphylococcus aureus y sus perfiles de resistencia a antibióticos en niños que viven en zonas de gran altitud del sudoeste de China. Arch. argent. pediatr. [online]. 2017, vol.115, n.3 [citado 2021-10-23], pp.274-276. Disponible en: http://www.scielo.org.ar/scielo.php?script=sci_arttext&pid=S0325-00752017000300011&lng=es&nrm=iso. ISSN 0325-0075. http://dx.doi.org/10.5546/aap.2017.274.
37. González Lorenzo A. 2003. Resistencia antimicrobiana “in vitro”. Sistema Diramic 10. Un año de experiencia. Rev Méd Electrón [Internet]. [citado 12 Feb 2013];25(6). Disponible en: http://www.revmatanzas.sld.cu/revista%20medica/ano%202003/vol6%202003/tema05.htm
38. González Martínez Miguel Luis, López Novo Magaly, Montesino López Maipú, Pérez Plana Yerandy, Martínez Sánchez Heraldo. Resistencia microbiana de microorganismos aislados en neonatología: Hospital “Abel Santamaría Cuadrado” 2015. Rev Ciencias Médicas [Internet]. 2016 oct [citado 2019 Nov 21]; 20(5): 64-75. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1561-31942016000500009&lng=es.
39. González MS, Pérez AG. Proposal of actions to improve accessibility at the Hotel Las Yagrumas, Artemisa. Management (Montevideo) 2024;2:25–25. https://doi.org/10.62486/agma202425.
40. González, M.L., Martínez Magaly., López, N., Montesino Maipú., Pérez, Y e Martínez, H. 2016. Resistencia microbiana de microorganismos aislados en neonatología: Hospital “Abel Santamaría Cuadrado” 2015. Revista de Ciencias médicas de Pinar del Rio. 20 (5)
41. González, M.M.L., López, N.M., Montesino, L.M, Pérez, P.Y y Martínez, S.H. 2016. Resistencia microbiana de microorganismos aislados en neonatología: Hospital. Rev Ciencias Médicas. 20 (5): 593-602.
42. Gonzalez-Argote J, Castillo-González W. Problem-Based Learning (PBL): review of the topic in the context of health education. Seminars in Medical Writing and Education 2024;3:57–57. https://doi.org/10.56294/mw202457.
43. Guzmán, A., Sánchez, T., De la Barra, R. 2012. Análisis de la monitorización de cinco indicadores de calidad del hemocultivo en un hospital universitario en Chile 2009-2011. Rev Chilena Infectol. 29:406-411
44. Hernández-Flórez N, Rosa EB de la, Klimenko O, Santander MJO, Araque-Barboza F, Vásquez-Torres J. Cognitive Impairment in the Elderly: A systematic review of the literature. Salud, Ciencia y Tecnología 2024;4:799–799. https://doi.org/10.56294/saludcyt2024799.
45. Herrera, M., Vargas, A., Moya Tatiana., Marín, J.P., Campos Marlen y Herrera, J. F. 2003. Hemocultivos en el Hospital Nacional de Niños Experiencia de 9 años 1995 – 2003. Rev. méd. Hosp. Nac. Niños (Costa Rica) vol.38 n.1-2
46. İpek MA, Yıldırım AC, Büyükbudak E, Tomás J, Severino S, Sousa L. Physical activity and successful aging: community-based interventions for health promotion. Community and Interculturality in Dialogue 2024;4:.157-.157. https://doi.org/10.56294/cid2024.157.
47. Koneman. Diagnóstico microbiológico. 2012
48. Kravchenko H, Ryabova Z, Kossova-Silina H, Zamojskyj S, Holovko D. Integration of information technologies into innovative teaching methods: Improving the quality of professional education in the digital age. Data and Metadata 2024;3:431–431. https://doi.org/10.56294/dm2024431.
49. Lara Magdalena. 2016. Identificación rápida de cocos Gram positivos en cadena en hemocultivos mediante técnicas de aglutinación de látex Rev Esp Quimioter 26 (1): 76-77
50. Leclerq R. Mechanisms of resistance to macrolides and lincosamides: nature of the resistance elements and their clinical implications. Clin Infect Dis. 2002. 34:482–92.
51. Liu H, Buescher G, Lewis N, Snyder S, Jungkind D. Detection of borderline oxacillin-resistant Staphylococcus aureus and differentiation from methicillinresistant strains. Eur J Clin Microbiol Infect Dis. 1990. 9:717–24.
52. Lona, J.C., Verdugo, M.A., Pérez, R.O., Pérez, J.J y Ascencio, E.P. 2015. Etiología y patrones de resistencia antimicrobiana en sepsis neonatal temprana y tardía, en una Unidad de Terapia Intensiva Neonatal. Arch. Argent. Pediatr. [Online]. Vol.113 (4) [citado 2016-03-16], pp. 317-323. Disponible en: http://www.scielo.org.ar/scielo.php?script=sci_arttext&pid=S0325-00752015000400007&lng=es&nrm=iso
53. López DES, Cruz AE. Clinical experience of a patient with hemopericardium. Multidisciplinar (Montevideo) 2024;2:69–69. https://doi.org/10.62486/agmu202469.
54. Losada MF. The Organizational Culture as a Driver of Business Growth: A Comprehensive Approach. SCT Proceedings in Interdisciplinary Insights and Innovations 2024;2:237–237. https://doi.org/10.56294/piii2024237.
55. Macfaddin JF. Pruebas bioquímicas para la identificación de bacterias de importancia clínica. 3ª. ed. t-1. La Habana: Ciencias Médicas; 2006.p. 344-61.
56. Manual de Laboratorio para la Identificación y Prueba de Susceptibilidad a los Antimicrobianos de Patógenos Bacterianos de Importancia para la Salud Pública en el Mundo en Desarrollo. WHO 2003. WHO/CDS/CSR/RMD/2003.6. Atlanta, Georgia: Centros para el Control y la Prevención de Enfermedades; Switzerland: Organización Mundial de la Salud, 2004
57. Medina, D.A., Machado, M.E y Machado., J.E. 2015. Resistencia a antibióticos, una crisis global. Rev. Méd. Risaralda. 21 (1): 74
58. Mensa J, et al. 2013. Guía de tratamiento antimicrobiano de la infección por Staphylococcus aureus. Review Espanish Quimioterapy 26 (Suppl. 1):1-84.) y (Abarca, G. y Herrera, M.L. 2001. Betalatamasas: su importancia en la clínica y su detección en el laboratorio. Review Medical Hospital 36(1-2):77-104)
59. Montenegro AN, Bálsamo F, Brusca MI, Zunini G, Jewtuchowicz V. Influence of vegan and vegetarian diet on oral health. AG Salud 2024;2:116–116. https://doi.org/10.62486/agsalud2024116.
60. Morales GI, Yaneth MC, Chávez KM. Caracterización de la resistencia in vitro a diferentes antimicrobianos en cepas de Staphylococcus spp. en una institución hospitalaria de la ciudad de Valledupar entre enero y julio de 2009. Rev Cienc Salud 2012; 10: 169-177
61. Morosini, M. Isabel., Cercenadob Emilia., Ardanuyc Carmen y Torresd Carmen. 2012. Detección fenotípica de mecanismos de resistencia en microorganismos grampositivos
62. Noda Albelo, AL; Vidal Tallet, LA; Vidal Casal, JI y Hernandez Alvarez L. Utilización de la penicilina en la infección extrameníngea por Streptococcus pneumoniae. Rev Cubana Pediatr 2011; 83:405-12.
63. Ñañez-Silva MV, Lucas-Valdez GR, Larico-Quispe BN, Peñafiel-García Y. Education for Sustainability: A Data-Driven Methodological Proposal for the Strengthening of Environmental Attitudes in University Students and Their Involvement in Policies and Decision-Making. Data and Metadata 2024;3:448–448. https://doi.org/10.56294/dm2024448.
64. Ocampo-Palacio Alejandro, Castrillón-Spitia Juan Daniel, Rivera-Echeverry Clara Inés, Londoño-Montes Juliana, Martínez-Betancur Sofía, Machado-Alba Jorge Enrique. Prescripción de antibióticos en infecciones de piel y tejidos blandos en una institución de primer nivel. CES Med. [Internet]. 2018 Apr [cited 2018 Nov 21] ; 32( 1 ): 3-13. URL. Disponible en: http://www.scielo.org.co/scielo.php?script=sci_arttext&pid=S0120-87052018000100003&lng=en. http://dx.doi.org/10.21615/cesmedicina.32.1.
65. Ogolodom MP, Egop EB, Alazigha N, Rufus A, Ezugwu EE, Ikegwuonu NC, et al. Magnetic resonance imaging findings in cervical pathologies and its’ correlation with patient´s body mass index in Anambra state, Nigeria: a cross-sectional study. Multidisciplinar (Montevideo) 2024;2:68–68. https://doi.org/10.62486/agmu202468.
66. Oliva E, Díaz M. Exploration of regularities in bipartite graphs using GEOGEBRA software. LatIA 2024;2:51–51. https://doi.org/10.62486/latia202451.
67. Organización Mundial de la Salud (OMS). 2000. Resistencia a los antimicrobianos: una amenaza mundial. Bol. Medicam. Escenciales, vol. 28–29, pp. 1–36.
68. Organización Mundial de la Salud (OMS). 2017. Centro de prensa. Resistencia a los antibióticos. [Online consultado 26 abril 2021]. Disponible: http://www.who.int/mediacentre/factsheets/antibiotic-resistance/es/.
69. Ortega L. María. 2010. Enterococos: actualización. Revista Habanera de Ciencias Médicas 2010:9(4) 507-515
70. Ortega P, Virgilito A. Zygomatic Implants: The importance of the correct choice of surgical technique. Odontologia (Montevideo) 2024;2:124–124. https://doi.org/10.62486/agodonto2024124.
71. Oubellouch H, Aziz S. Risk assessment for the liquefied petroleum gas filling industry using fuzzy logic and hazard and operability. Salud, Ciencia y Tecnología 2024;4:749–749. https://doi.org/10.56294/saludcyt2024749.
72. Özenci V, Tegmark-Wisell K, Lundberg C, Wretlind B. 2007. Rapid culture and identification: a practical method for early preliminary laboratory diagnosis of sepsis. Eur J Clin Microbiol Infect Dis.14:174-89
73. P LR. Innovating in Mental Health: Metacognitive Psychotherapy. Interdisciplinary Rehabilitation / Rehabilitacion Interdisciplinaria 2024;4:74–74. https://doi.org/10.56294/ri202474.
74. Parada REA, Ferrer MF, Astbury M de los Á, Brazza S. Frequency of cases of Argentine Hemorrhagic Fever in the province of Santa Fe between the years 2018 to 2022. AG Salud 2024;2:119–119. https://doi.org/10.62486/agsalud2024119.
75. Pardinas, M.J., Alarcón, A., Ramírez, C., Rodríguez, F y Díaz, E. 2017. Probabilidad de éxito de obtener un hemocultivo positivo. Med Int Méx. 33 (1): 28-40
76. Parra AL, Escalona E, Navarrete FB. Physical fitness assessment of a Venezuelan industrial direct labor force population. Interdisciplinary Rehabilitation / Rehabilitacion Interdisciplinaria 2024;4:88–88. https://doi.org/10.56294/ri202488.
77. Paz-Montes, A., Fuenmayor, Alisbeth., Sandrea, L., Piña-Reyes, E., López-Dávila, M y Navarro, P. 2015. Incidencia de microorganismos en hemocultivos procesados en un hospital del estado Zulia y su resistencia a los agentes antimicrobianos. Kasmera. 43 (1): 16 – 33.
78. Peña-Méndez A, Gutiérrez EI, Hernández IM, Díaz-González Y, Crispin-Castellanos D. Didactic strategy for the training of skills in clinical trials of Stomatology residents. Seminars in Medical Writing and Education 2024;3:59–59. https://doi.org/10.56294/mw202459.
79. Perfomance Standards for Antimicrobial susceptibility testing; fourteenth Informational Suplements, M100-S15.2005.NCCLS, Wayne (PA). USA. [en línea]. 2004 Jun [citado 2018 Dic 18];24. URL. Disponible en: http://scholar.google.com.cu/scholar?q=+Performance+Standards+for+Antimicrobial+Susceptibility+Testing.&btnG=&hl=es&as_sdt=0%2C5
80. Ramírez-Salinas Y, Zayas-Illas A, Collado-Yero R, Cabrera-Nuñez MV, Zayas-Martínez GI, Cuza-Turcáz C. Detección de resistencia inducible a clindamicina de Staphylococcus aureus resistente a meticilina. Havana, Cuba: 8th Cuban Congress on Microbiology and Parasitology, 5th National Congress on Tropical Medicine and 5th International Symposium on HIV/aids infection in Cuba. 14 al 16 de octubre de 2014.
81. Razooq AM, Sayhood EK, Resheq AS. Effects of steel reinforcement ratios on the flange effective width for reinforced concrete T-beams casting with recycled coarse aggregate. Salud, Ciencia y Tecnología - Serie de Conferencias 2024;3:820–820. https://doi.org/10.56294/sctconf2024820.
82. Redgrave LS, Sutton SB, Webber MA, Piddock LJ V. Fluoroquinolone resistance: mechanisms, impact on bacteria, and role in evolutionary success. Trends Microbiol [Internet]. 1 de agosto de 2014; 22 (8): 438-45. Disponible en: https://doi.org/10.1016/j.tim.2014.04.007 DOI: 10.1016/j.tim.2014.04.007 PMID 24842194 Google Académico Microsoft Académico
83. Rice LB. 2006. Antimicrobial resistance in gram-positive bacteria. doi: 10.1016/j.ajic.2006.05.220
84. Rivas JP. State administrative reparation to the victims within the framework of theJEP in the Municipality of Quibdo in the period 2018-2022. SCT Proceedings in Interdisciplinary Insights and Innovations 2024;2:239–239. https://doi.org/10.56294/piii2024239.
85. Riveros ER, Espinoza MÁL. Relationship between sociodemographic factors and quality of life in hemodialysis patients. Salud, Ciencia y Tecnología 2024;4:744–744. https://doi.org/10.56294/saludcyt2024744.
86. Roberts JA, Roberts MS, Semark A, Udy A, Kirkpatrick C, Paterson D. 2011. Antibioticdosing in the `at risk’ critically ill patient: Linking pathophysiology with pharmacokinetics/pharmacodynamics in sepsis and trauma patients. BMC Anesthesiology. 2011 [citado 12 Oct 2021]; 11(3). Disponible en: http://bmcanesthesiol.biomedcentral.com/articles/10.1186/1471-2253-11-3
87. Rybak MJ. 2006. Pharmacodynamics: Relation to antimicrobial resistance. Am J Infect Control. 34: S38-45.
88. Sanabria G. Correlación de serotipos, sensibilidad y resistencia antimicrobiana en niños con infecciones invasivas por Streptococcuspneumoniae en un centro de referencia de Asunción-Paraguay. Revisión de 6 años. Rev. Inst. Med. Trop 2009;4: 14-24.
89. Sánchez-Castillo V, Romero RÁ, Olascoaga BGJ. Analysis of research trends on the implementation of information systems in the agricultural sector. Data and Metadata 2024;3:442–442. https://doi.org/10.56294/dm2024442.
90. Sandrea-Toledo LB, Piña-Reyes EJ, Paz-Montes A, Torres-Urdaneta EL. Determinación de la resistencia a meticilina meticilina y eritromicina de cepas de Staphylococcus aureus aisladas en un hospital del estado Zulia. Rev Soc Ven Microbiol 2012; 32: 88-94
91. Santisteban Yesleisy., Carmona, Y., Pérez, Y., Díaz Lilian., García Sandra y Kobayashi, N. 2014. Infecciones por los géneros Klebsiella y Acinetobacter en hospitales pediátricos cubanos y resistencia antibiótica. Rev cubana Med Trop [revista en la Internet]. Dic [citado 2015 jun 17]; 66(3): 400-414. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0375-07602014000300008&lng=es
92. Savitha D, Sudha L. Sentence level Classification through machine learning with effective feature extraction using deep learning. Salud, Ciencia y Tecnología - Serie de Conferencias 2024;3:702–702. https://doi.org/10.56294/sctconf2024702.
93. Siberry GK, Tekle T, Caroll D, Dick J. Failure of clindamycin treatment of methicillin-resistant Staphylococcus aureus expressing inducible clindamycin resistance in vitro. Clin Infect Dis. 2003; 37:1257-1260.
94. Sidiq M, Chahal A, Gupta S, Vajrala KR. Advancement, utilization, and future outlook of Artificial Intelligence for physiotherapy clinical trials in India: An overview. Interdisciplinary Rehabilitation / Rehabilitacion Interdisciplinaria 2024;4:73–73. https://doi.org/10.56294/ri202473.
95. Tamariz-Ortiz JH, Cruz-Quintanilla J, Atencia-Porras A, Figueroa-Tataje J, Horna-uintana G, Guerra-Allison H. Resistencia a clindamicina inducida por eritromicina en Staphylococcus aureus aislados de tres hospitales de Lima, Perú. Acta Médica Peruana 2009; 26: 12-16.
96. Trujillo Rodríguez Yordanka,I Fernández Alfonso Jana M., González Lorenzo Ariadna, López García Idalmis, Delgado Pérez Lenia. Resistencia microbiana de gérmenes aislados en pacientes de las unidades de cuidados intensivos e intermedios. Hospital Universitario Clínico Quirúrgico Comandante Faustino Pérez. 2010. Rev Med Electrón 2012 [Citado 2021 oct 18]; 34(5). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1684-18242012000500001
97. Tubau, F., Liñares Josefina y Martin, R. 2000. Resistencia antibiótica en Streptococcus pneumoniae. http://192.168.100.2/control/reviBacte/pnepp.htm. 1-6
98. Virú Yamilet. 2019. Caracterización microbiológica de bacterias aisladas de catéter venoso de pacientes hospitalizados en el Hospital Nacional Docente Madre Niño San Bartolomé de noviembre del 2017 a diciembre del 2018. Tesis en opción al Título Profesional de Licenciada en Tecnología Médica en el área de Laboratorio Clínico y Anatomía Patológica. Universidad Nacional Mayor de San Marcos. 83 p
99. Volodymyr V, Kolumbet V, Halachev P, Khambir V, Ivanenko R. Methods and algorithms of optimization in computer engineering: review and comparative analysis. Data and Metadata 2024;3:443–443. https://doi.org/10.56294/dm2024443.
100. Weyland BS, Losada M, Molelrach M, Bonofiglio L, De Mier C, Garcia SA, Vay C, Rodriguez CH, Famiglietti A. Evaluación de la actividad de diferentes antimicrobianos frente a Streptococcus pneumoniae provenientes de pacientes adultos con neumonía adquirida en la comunidad. Revista Americana de medicina respiratoria 2011; 11:117-24.
101. Worley H. 2003. La resistencia a los antimicrobianos pone en riesgo el avance médico. Population reference bureau [citado 15 Feb 2013]. Disponible en: http://www.prb.org/SpanishContent/Articles/2006/LaResistenciaalosAntimicrobianosPoneenRiesgoelAvanceMedico.aspx
102. Zapata RE, Guerrero EC, Montilla RE. Emerging Technologies in Education: A Bibliometric Analysis of Artificial Intelligence and its Applications in Health Sciences. Seminars in Medical Writing and Education 2024;3:49–49. https://doi.org/10.56294/mw202449.
103. Zapata RJ. Gentrified Humanities? An analysis of the main trends in the Scopus database. Gentrification 2024;2:53–53. https://doi.org/10.62486/gen202453.
FINANCIACIÓN
Ninguna.
CONFLICTO DE INTERÉS
Ninguno.
CONTRIBUCIÓN DE AUTORÍA
Conceptualización: Noel Suarez Reyes, Miguel Luis González Martínez, Kirenia Apaulaza Corrales, Diana Lobo Riverol, Leidy Liana López Ramos.
Curación de datos: Noel Suarez Reyes, Miguel Luis González Martínez, Kirenia Apaulaza Corrales, Diana Lobo Riverol, Leidy Liana López Ramos.
Análisis formal: Noel Suarez Reyes, Miguel Luis González Martínez, Kirenia Apaulaza Corrales, Diana Lobo Riverol, Leidy Liana López Ramos.
Redacción – borrador original: Noel Suarez Reyes, Miguel Luis González Martínez, Kirenia Apaulaza Corrales, Diana Lobo Riverol, Leidy Liana López Ramos.
Redacción – revisión y edición: Noel Suarez Reyes, Miguel Luis González Martínez, Kirenia Apaulaza Corrales, Diana Lobo Riverol, Leidy Liana López Ramos.