doi: 10.56294/hl2024.550
ORIGINAL
In vitro evaluation of antibacterial and antioxidant activity of malva sylvestris and malva pseudolavatera extracts
Evaluación in vitro de la actividad antibacteriana y antioxidante de los extractos de malva sylvestris y malva pseudolavatera
Yamilet Irene Gutiérrez Gaitén1 ![]() *, Glenda Marcela Sarmiento Tomalá2
*, Glenda Marcela Sarmiento Tomalá2 ![]() *, Alondra Idrovo Encalada2
*, Alondra Idrovo Encalada2 ![]() *, Zoraida Burbano Gómez2
*, Zoraida Burbano Gómez2 ![]() *, Pilar Asunción Soledispa Cañarte2
*, Pilar Asunción Soledispa Cañarte2 ![]() *, Alexandra López Barrera2
*, Alexandra López Barrera2 ![]() *, Carlos Jefferson Valdiviezo Rogel2
*, Carlos Jefferson Valdiviezo Rogel2 ![]() *, Francisca Patricia
Jimenez Granizo2
*, Francisca Patricia
Jimenez Granizo2 ![]() *
*
1Universidad de la Habana, Instituto de Farmacia y Alimentos. Ciudad Habana, Cuba.
2Universidad de Guayaquil, Facultad de Ciencias Químicas. Guayaquil, Ecuador.
Citar como: Gutiérrez Gaitén YI, Sarmiento Tomalá GM, Idrovo Encalada A, Burbano Gómez Z, Soledispa Cañarte PA, López Barrera A, et al. In vitro evaluation of antibacterial and antioxidant activity of malva sylvestris and malva pseudolavatera extracts. Health Leadership and Quality of Life. 2024; 3:.550. https://doi.org/10.56294/hl2024.550
Enviado: 08-07-2023 Revisado: 10-12-2023 Aceptado: 24-04-2024 Publicado: 25-04-2024
Editor: PhD.
Prof. Neela Satheesh ![]()
Autor para la correspondencia: Yamilet Irene Gutiérrez Gaitén *
ABSTRACT
In the present research work has done the evaluation of the antibacterial activity of aqueous and hydroalcoholic extracts of the leaves of Malva sylvestris and Malva pseudolavatera, against three microorganisms (Escherichia coli, Staphylococcus aureus, Klebsiella pneumoniae) and antioxidant evaluation of hydroalcoholic extracts, with the goal to provide an alternative in the treatment of infectious and chronic degenerative diseases. The antibacterial activity was performed by disk diffusion assays using Cefotaxime as a reference antibiotic; The antioxidant activity was carried out by three in vitro methods, the method of FRAP (ferro-reducing capacity), 2,2-diphenyl-1-picrylhydracil (DPPH) and 2,2’- azino-bis (3-ethylbenzothiazoline)-6-sulfonic (ABTS•+). The results obtained indicated that the analyzed extracts of both Malva species showed a moderate antibacterial activity in certain concentrations against the microorganisms E. coli,S. aureus and K. pneumoniae; and taking into account the results of the antioxidant activity in the three in vitro methods tested, it was I observed that as the concentration of the extracts increased, the reducing power (FRAP test) and the anti-radicals activity (DPPH and ABTS•+ tests) increased as well, manifesting a high antioxidant activity. As a consequence of this, we can conclude that Malva sylvestris and Malva pseudolavatera leaf extracts produce inhibition halos in the strains of the microorganisms evaluated (E. coli, S. aureus, K. pneumoniae), in addition to presenting inhibition of the radicals used (DPPH, ABTS•+) and ferro- reducing capacity (FRAP).
Keywords: Antibacterial; Antioxidant; Malva Sylvestris; Malva Pseudolavatera; Free Radicals.
RESUMEN
En el presente trabajo de investigación se realizó la evaluación de la actividad antibacteriana de extractos acuosos e hidroalcohólicos de las hojas de Malva sylvestris y Malva pseudolavatera, contra tres microorganismos (Escherichia coli, Staphylococcus aureus, Klebsiella pneumoniae) y la evaluación antioxidante de los extractos hidroalcohólicos, con la finalidad de brindar una alternativa en el tratamiento de enfermedades infecciosas y crónico-degenerativas. La actividad antibacteriana se realizó por ensayos de difusión en discos utilizando Cefotaxima como antibiótico de referencia; la actividad antioxidante se llevó a cabo mediante tres métodos in vitro, el método de FRAP (capacidad ferroreductora), 2,2-difenil- 1-picrilhidracilo (DPPH) y ácido 2,2’-azino-bis (3-etilbenzotiazolina)-6-sulfónico (ABTS•+). Los resultados obtenidos indicaron que los extractos analizados de ambas especies de Malva presentaron una actividad antibacteriana moderada en determinadas concentraciones frente a los microorganismos E. coli, S. aureus y K. pneumoniae; y teniendo en consideración los resultados de la actividad antioxidante en los tres métodos in vitro ensayados se pudo constatar que a medida que aumentaba la concentración de los extractos, aumentaba el poder reductor (ensayo FRAP) y la actividad antirradicalaria (ensayos DPPH y ABTS•+) de los mismos, manifestándose una elevada actividad antioxidante. Como consecuencia de esto, podemos concluir que los extractos de las hojas de Malva sylvestris y Malva pseudolavatera producen halos de inhibición en las cepas de los microorganismos evaluados (E. coli, S. aureus, K. pneumoniae), además de presentar inhibición de los radicales empleados (DPPH, ABTS•+) y capacidad ferro-reductora (FRAP).
Palabras clave: Antibacteriana; Antioxidante; Malva Sylvestris; Malva Psedolavatera; Radicales Libres.
INTRODUCCIÓN
Actualmente el uso de las plantas medicinales ha tomado mayor relevancia en las poblaciones rurales debido a que presentan una contribución muy importante en el sistema de salud.(1,2,3,4) Ecuador se ha convertido en uno de los países con gran potencial en la medicina tradicional ya que tiene muchas variedades de plantas con muchos beneficios curativos que podrían ser utilizados para el tratamiento de múltiples enfermedades en las diferentes comunidades del país.(5,6,7,8,9)
Se han realizado algunos estudios sobre la planta de Malva, en especial de la especie sylvestris, en donde se ha evaluado diferentes acciones farmacológicas y se ha podido observar que esta planta tiene acción antiinflamatoria, digestiva, antioxidante y cicatrizante, todo esto gracias a que posee varios metabolitos secundarios con gran actividad farmacológica, entre estos están: alcaloides, flavonoides, mucílagos, quinonas, saponinas, taninos, resinas, entre otros.(10,11,12,13,14,15)
En los últimos años, las enfermedades infecciosas en piel y tejidos son un problema para los diferentes sitios de salud pública, en donde se emplea antibióticos como tratamiento, que en muchas ocasiones no siempre son administrados de forma adecuada y las infecciones persisten dando origen una resistencia bacteriana en el paciente tratado.(16,17,18,19,20)
Debido a la resistencia antibacteriana que presentan muchos pacientes por el uso incorrecto de antibióticos, la Organización Mundial de la Salud (OMS) considera el tratamiento de las enfermedades infecciosas con antibióticos un verdadero problema de salud pública que puede afectar a cualquier persona.(21,22,23)
Como consecuencia de este fenómeno, enfermedades bacterianas que actualmente pueden ser tratadas podrían volverse incontrolables y propagarse de manera rápida a nivel global, por lo que se requiere corregir el uso incorrecto de antibióticos y a su vez emplear como alternativa el uso de plantas medicinales que puedan contribuir en el tratamiento de infecciones causadas por distintos microorganismos.(24,25,26)
Por otra parte, debido a la presencia de ciertos metabolitos en plantas del género Malva es que se ha optado por evaluar también su actividad antioxidante para evitar la formación de radicales libres derivados de oxígeno, los cuales son causantes de diversas enfermedades crónico-degenerativas en los seres humanos y son de relevancia clínica significativa. Los radicales libres son moléculas químicas que presentan un electrón en el orbital externo libre, y esto produce una configuración espacial poco estable; son muy reactivos y tienen una vida media corta.(27,28,29)
Los seres humanos poseen sistemas de defensa naturales (antioxidantes) dentro del organismo que impiden que se generen efectos nocivos por la presencia de los radicales libres, neutralizándolos. Sin embargo, cuando hay un déficit de antioxidantes en el organismo, no tienen la capacidad de equilibrar los radicales libres y estos pueden provocar efectos dañinos, como lo es el estrés oxidativo (daño celular).(30)
En el presente trabajo se pretende emplear dos especies del género Malva, sylvestris y pseudolavatera, para evaluar su actividad antibacteriana y antioxidante, realizando una comparación entre ambas y a su vez brindar una alternativa en el tratamiento de enfermedades infecciosas y cancerígenas.
¿Cuáles serán los diámetros de los halos de inhibición y disminución de radicales libres que presentan los extractos de Malva sylvestris y Malva pseudolavatera?
Objetivo General
Evaluar la actividad antibacteriana y antioxidante de los extractos de Malva sylvestris y Malva pseudolavatera en diferentes concentraciones.
MÉTODO
Análisis de las variables
Variable dependiente
· Halo de inhibición.
· Crecimiento bacteriano.
· Capacidad antioxidante.
Variable independiente
· Extractos de Malva sylvestris y Malva pseudolavatera.
· Concentraciones evaluadas de los extractos.
Operacionalización de las variables
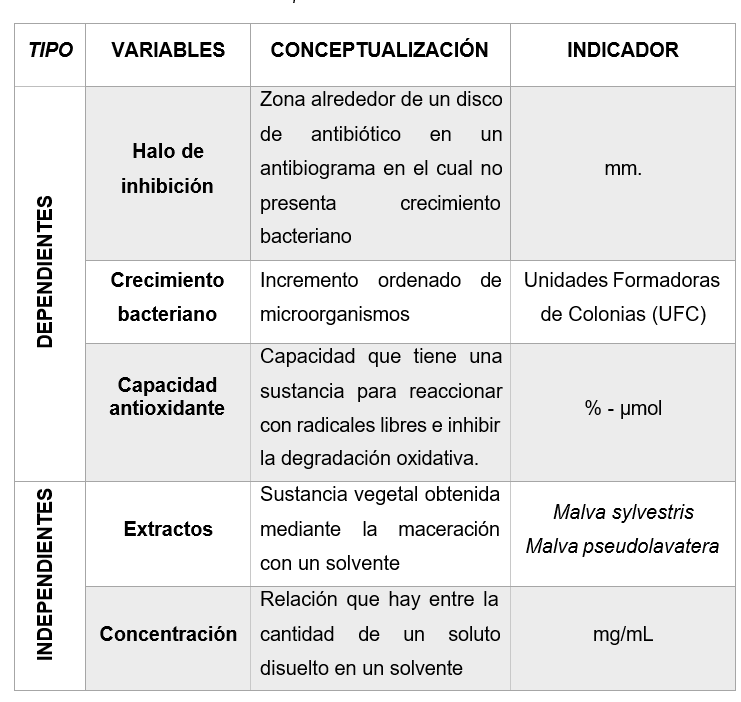
Fuente: Abrigo & Goyes, 2019
Figura 1. Operacionalización de las variables
Tipo de investigación
La investigación es de carácter hipotético, cuantitativo y experimental, sobre la actividad antibacteriana y antioxidante de Malva sylvestris y Malva pseudolavatera. Debido que al inicio del estudio se planteó una hipótesis, el cual a través de la experimentación de los ensayos in vitro y cuantificación de los resultados obtenidos será aceptada o rechazada, indicando si alguna de las dos especies de Malva presenta actividad antibacteriana o antioxidante.
Equipos, Materiales y Reactivos
Equipos
Fuente: Abrigo & Goyes, 2019
Figura 2. Equipos utilizados en el análisis
Materiales
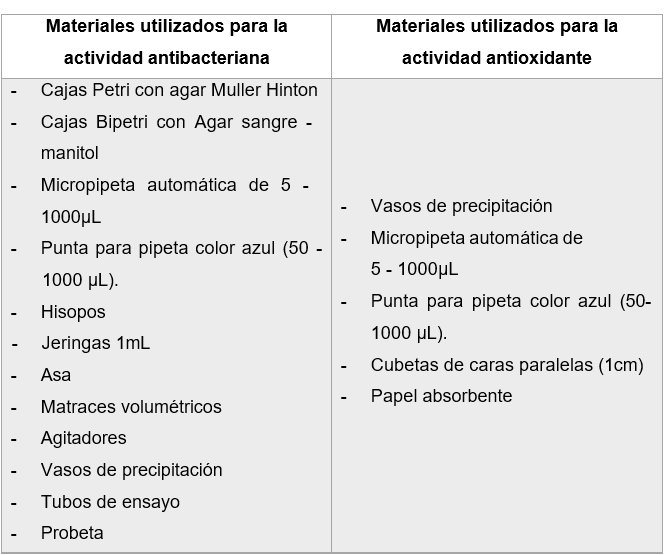
Fuente: Abrigo & Goyes, 2019
Figura 3. Materiales usados
Material vegetal y biológico
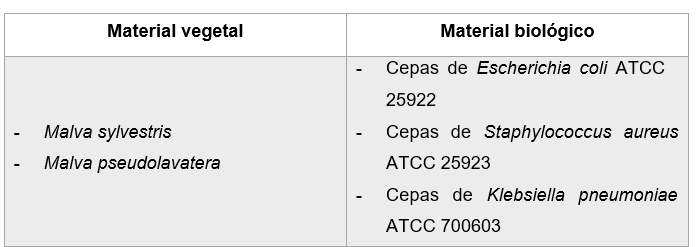
Fuente: Abrigo & Goyes, 2019
Figura 4. Material vegetal y biológico
Reactivos
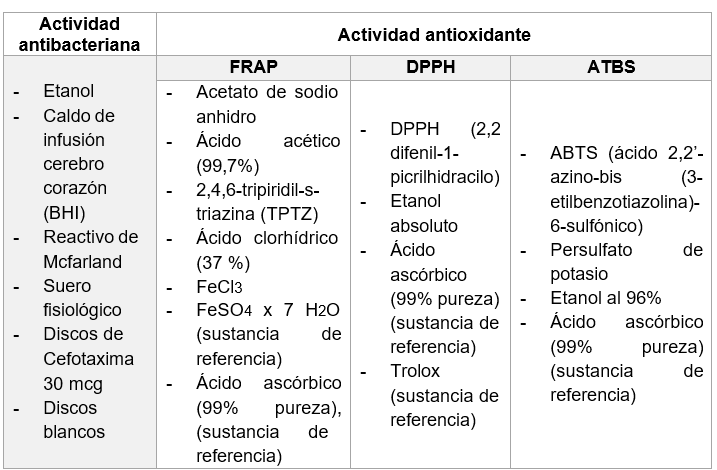
Fuente: Abrigo & Goyes, 2019
Figura 5. Reactivos que se utilizaron en el análisis
Muestra
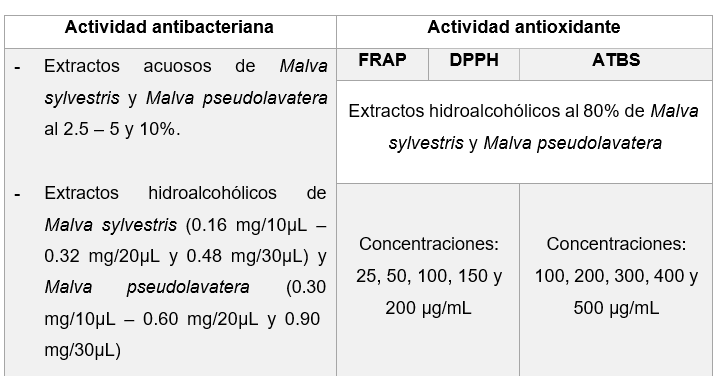
Fuente: Abrigo & Goyes, 2019
Figura 6. Actividad antibacteriana y antioxidante
Metodología Experimental
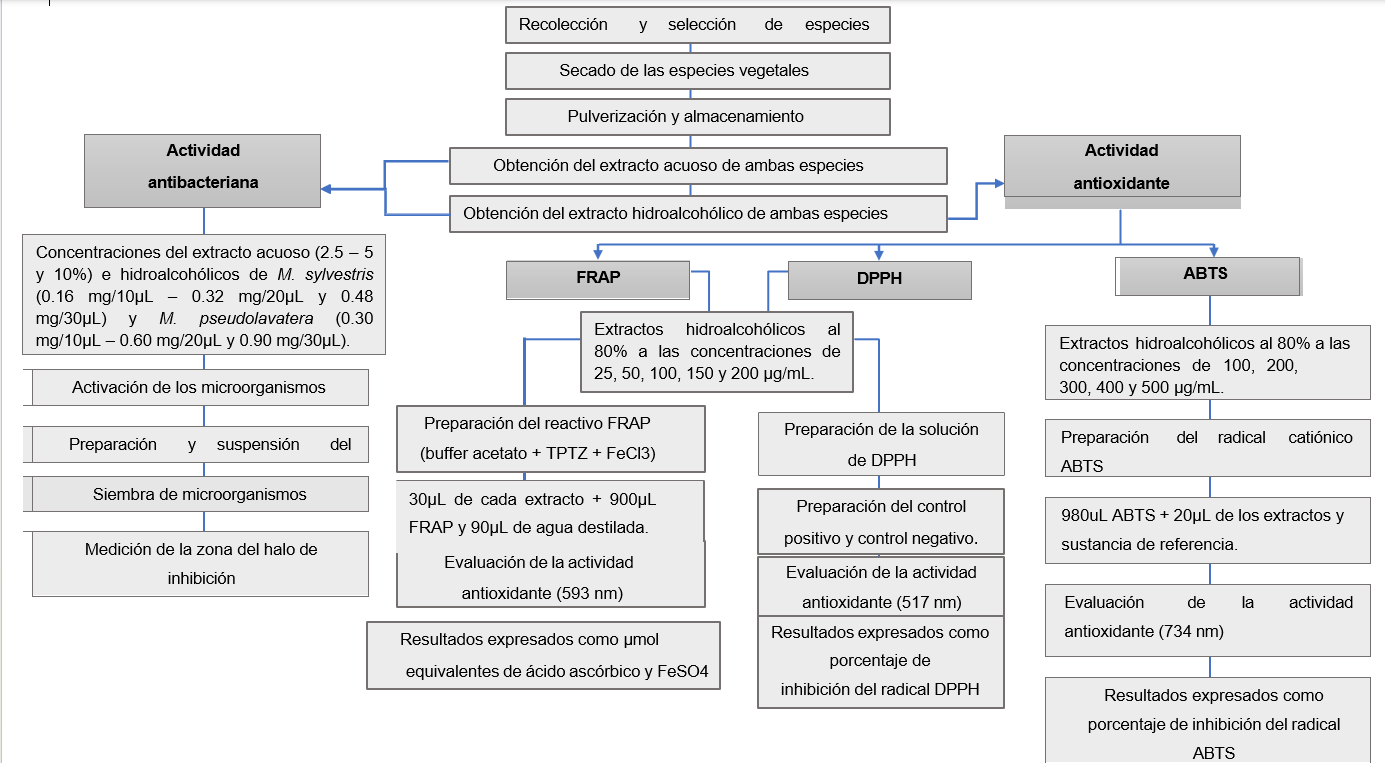
Fuente: Abrigo & Goyes, 2019
Figura 7. Metodología experimental de la actividad antimicrobiana y antioxidante
Recolección y selección de especies de Malva
La recolección de las especies vegetales constituidas por Malva sylvestris y Malva pseudolavatera, fueron obtenidas en la provincia de Chimborazo, cantón Guano y seleccionadas con el fin de establecer una comparación de la actividad antibacteriana y antioxidante de ambas especies.
Secado de las especies vegetales
Las dos especies de Malva fueron previamente limpiadas de sus impurezas y se procedió a exponerlas a un secado natural sin exposición del sol.
Pulverización y almacenamiento
Luego del secado natural, se deshojó las plantas de ambas especies, las hojas se llevaron a la estufa por un periodo de 2h a 50ºC. Posteriormente las hojas fueron trituradas en el molino eléctrico marca IKA MF10 BASIC a 3500 rpm. Una vez obtenido el pulverizado de ambas especies se dejaron almacenadas en funda ziploc a temperatura de refrigeración, para luego ser utilizado en la obtención del extracto hidroalcohólico.
Obtención del extracto acuoso de ambas especies
A partir de las muestras vegetales liofilizadas de Malva sylvestris y Malva pseudolavatera, se procedió a pesar la cantidad necesaria para las concentraciones establecidas (2,5 %, 5 % y 10 %) y para su disolución se empleó agua destilada. El extracto fue preparado el mismo día del análisis.
Obtención del extracto hidroalcohólico de ambas especies
A partir de las muestras vegetales pulverizadas de Malva sylvestris y Malva pseudolavatera, se procedió a pesar 50 g de polvo de cada una de las especies, se la humectó con 60 mL de solución hidroalcohólica (50:50) y se dejó macerar durante 48 horas con 150 mL de la misma solución hidroalcohólica a temperatura ambiente. Luego se filtró, se midió el volumen obtenido y se calculó su concentración.
Cálculo de la concentración de los extractos
Para calcular la concentración se tomó una alícuota de 5 mL, se la colocó en una cápsula previamente tarada, se dejó evaporar a sequedad en baño de agua y se pesó nuevamente.
Actividad antibacteriana
La evaluación de la actividad antibacteriana de los extactos obtenidos de Malva sylvestris y Malva pseudolavatera, se realizó mediante un análisis in vitro, utilizando el método de difusión en disco o tambien llamado técnica de Kirby- Bauer.
Preparación de las concentraciones de los extractos
Extracto acuoso
En diferentes vasos de precipitación, se trabajó con soluciones del extracto a diferentes concentraciones (2,5 %, 5 %, 10 %), para lo cual se realizaron cálculos a partir del liofilizado de ambas especies y se lo disolvió en 3 mL de agua destilada.
Extracto hidroalcohólico
A partir del extracto hidroalcohólico obtenido, se procedió a preparar las diferentes concentraciones del extracto de acuerdo con la especie vegetal, obteniendo en Malva sylvestris las siguientes concentraciones en volumenes diferentes (0,16 mg/10µL – 0,32 mg/20µL y 0,48 mg/30µL) y en Malva pseudolavatera (0,30 mg/10µL – 0,60 mg/20µL y 0,90 mg/30µL).
Activación de los microorganismos
Se realizó la siembra de los microorganismos antes de cada análisis, a partir de una cepa pura (E. coli ATCC 25922, S. aureus ATCC 25923, K. pneumoniae ATCC 700603) de cada uno, en cajas bipetri con agar Manitol (S. aureus) y agar Sangre (E. coli y K. pneumoniae); luego se las rotuló respectivamente y fueron colocadas en la incubadora a 37 °C durante 24 h.
Preparación y suspensión del inóculo
Se seleccionaron 4 ó 5 colonias de cada microorganismo del cultivo puro obtenido en la activación de microorganismos, se transfirieron las colonias utilizando un hisopo a un tubo estéril que contenía 3 mL de solución salina estéril, y se ajustó el inóculo a una turbidez equivalente al tubo 0,5 de la escala de McFarland, el cual corresponde a 108 microorganismos viables por mL.
Siembra de microorganismos
Se sumergió un hisopo estéril en la suspensión del inóculo y el exceso de líquido fue eliminado por rotación del hisopo contra las paredes del tubo de ensayo, luego se realizó la siembra en tres o cuatro direcciones sobre toda la superficie del medio de agar Mueller Hinton, girando dicha caja en ángulos de 90°.
Extracto acuoso
Se colocaron 20 µL de cada concentración del extracto acuoso sobre discos en blanco de la marca OxoidTM de 6 mm de diámetro, como control negativo se utilizó un disco en blanco con 20 µL de agua destilada y como control positivo (referencial) un disco de Cefotaxima; realizando cinco repeticiones. Las cajas Petri fueron debidamente rotuladas e incubadas a 37 °C durante 24 horas.
Extracto hidroalcohólico
Se colocaron tres volúmenes diferentes con sus respectivas concentraciones sobre discos en blanco de la marca OxoidTM de 6 mm de diámetro; como control negativo se utilizó un disco en blanco con 20 µL de solución hidroalcohólica (50:50) y como control positivo (referencial) un disco de Cefotaxima; realizando cinco repeticiones. Las cajas Petri fueron debidamente rotuladas e incubadas a 37°C durante 24 horas.
Medición de la zona del halo de inhibición
Para la interpretación de los resultados, se midió la zona de inhibición redondeando al perímetro más cercano al disco con una regla milimetrada, manteniendo la caja sobre el contador de colonias manual de campo oscuro de Quebec marca Reichert Technologies para medir con claridad el halo de inhibición, y luego se comparó con las medidas estandarizadas del control positivo por el CLSI de cada uno de los microorganismos utilizados.
Actividad antioxidante
Actividad antioxidante por el método de FRAP (capacidad ferro- reductora)
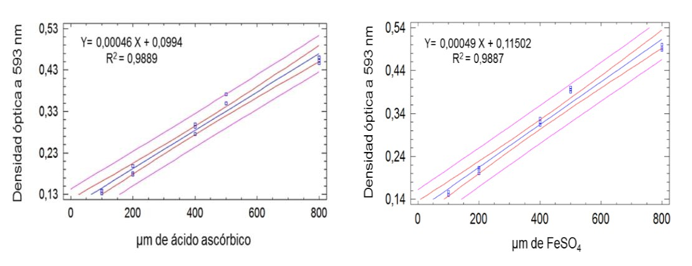
La capacidad de reducción de los extractos hidroalcohólicos fue medida acorde al procedimiento descrito por Benzie y Strain (1996). Las determinaciones fueron de carácter espectrofotométrico, se empleó un espectrofotómetro UV- visible a una absorbancia de 593 nm.
Concentraciones de los extractos
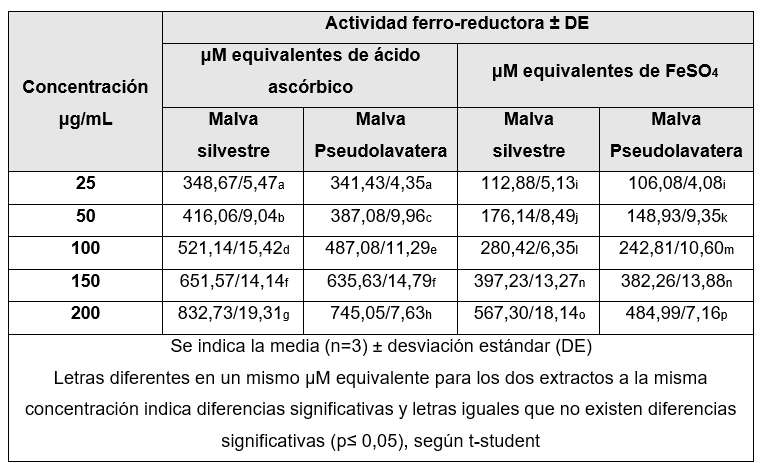
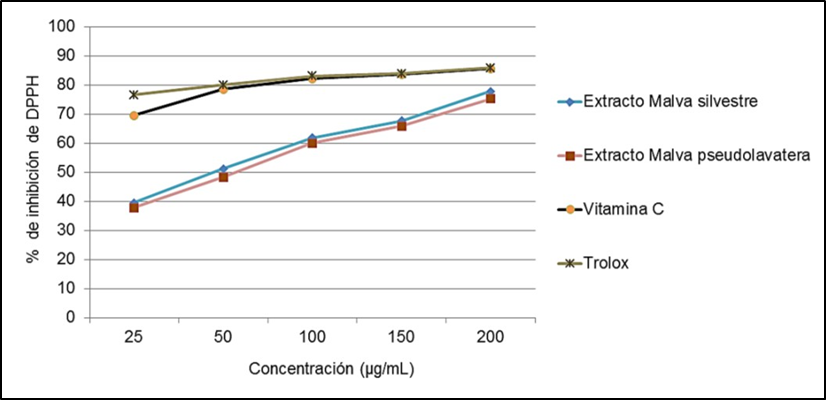
Los extractos hidroalcohólicos de Malva sylvestris y Malva pseudolavatera al 80 % fueron a las concentraciones de 25, 50, 100, 150 y 200 μg/mL.
Preparación de la solución FRAP
Para conformar el reactivo de FRAP, se mezcló buffer acetato de sodio 300 mM (pH 3,6), 10 mM de TPTZ (2,4,6-tripiridil-s-triazina) y 20 mM de cloruro férrico (25:2,5:2,5 v:v:v).
Evaluación de la actividad antioxidante
Se tomaron 30 μL de cada dilución de los extractos (a las concentraciones de 25, 50, 100, 150 y 200 μg/mL) y se mezclaron con 900 μL de la disolución FRAP y 90 μL de agua destilada. Una vez realizada la mezcla, la reacción que ocurre mide la reducción del complejo férrico-TPTZ, en la cual el hierro férrico (Fe3+ - TPTZ) se reduce a ión ferroso a bajo pH, causando la formación de un complejo ferroso-tripiridiltriazina (Fe2+ - TPTZ) de color azul intenso con un máximo de absorción a una longitud de onda de 593 nm. El blanco consistió en 120 μL de agua y 900 μL de reactivo. Cada determinación se llevó a cabo por triplicado.
Los resultados fueron expresados como μmol equivalentes de ácido ascórbico (EAA) y como μmol equivalentes de FeSO4, a partir del cálculo interpolando la densidad óptica (D.O) de las muestras en las curvas de calibración de ambas sustancias de referencia a las concentraciones de 100, 200, 400, 500 y 800 μM. Las lecturas se realizaron por triplicado a los cuatro minutos.
Capacidad secuestradora del radical 2,2-difenil-1-picrilhidrazilo (DPPH)
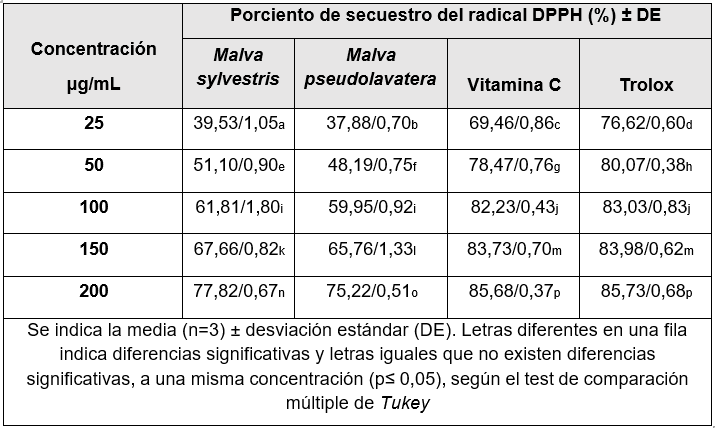
Para la evaluación de la actividad antioxidante de los extactos obtenidos de Malva sylvestris y Malva pseudolavatera, se realizó mediante la técnica del radical libre DPPH (radical 2,2-difenil-1-picrilhidracilo), basado en la metodología descrita por Brand-Willians et al., se empleó un espectrofotómetro UV-visible y las determinaciones fueron medidas a 517 nm al cabo de los 30 minutos.
Concentraciones de los extractos
Los extractos hidroalcohólicos de Malva sylvestris y Malva pseudolavatera fueron al 80 % en concentraciones de 25, 50, 100, 150 y 200 µg/mL.
Preparación de la solución de DPPH
La solución de DPPH fue preparada a una concentración de 0,075mg/mL en un matraz aforado cubierto con aluminio, empleando como solvente el metanol. Esta solución se debe preparar el mismo día que se va a realizar el ensayo dado que es una solución fotosensible. La solución debe almacenarse en un frasco color ámbar y mantenerse fuera del alcance de la luz.
Preparación del control positivo y control negativo
El control positivo utilizado en el ensayo de actividad antioxidante fue el ácido ascórbico en concentraciones de 25, 50, 100, 150 y 200 µg/mL utilizando como solvente el etanol absoluto.
El control negativo o blanco consistió en una mezcla de 900 µL de DPPH Y 100 µL de etanol absoluto.
Evaluación de la actividad antioxidante
Se tomaron 10 µL de cada concentración de los extractos (25, 50, 100, 150 y 200 μg/mL) y de las sustancias de referencia a las mismas concentraciones, se mezclaron con 900 µL del reactivo DPPH (0,075 mg/mL) y 90 µL de etanol absoluto. La reacción se dejó en la oscuridad durante 30 minutos en un espectrofotómetro y posteriormente se leyeron las muestras a una longitud de onda de 517 nm. Cada determinación se llevó a cabo por triplicado.
Los resultados fueron expresados como porcentaje de inhibición del radical DPPH según la siguiente fórmula:
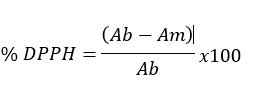
Donde:
· Ab: absorbancia del blanco (nm).
· Am: absorbancia de la muestra (nm).
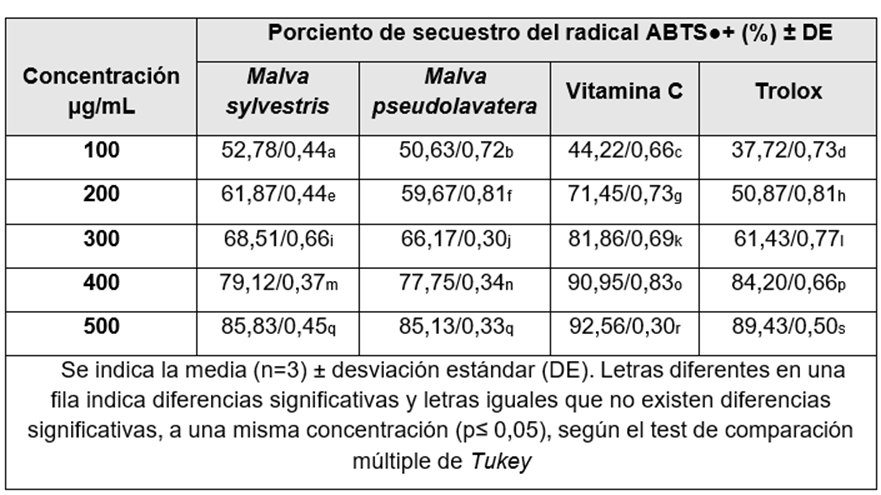
Ensayo del ABTS•+ (ácido 2,2’-azino-bis (3-etilbenzotiazolina)-6- sulfónico)
Para la evaluación de la actividad antioxidante de los extactos obtenidos de Malva sylvestris y Malva pseudolavatera, se realizó mediante la técnica del radical libre ABTS•+ (ácido 2,2’-azino-bis (3-etilbenzotiazolina)-6-sulfónico), se empleó un espectrofotómetro UV-visible y las determinaciones fueron medidas a 734 nm al cabo de los 30 minutos.
Concentraciones de los extractos
Los extractos hidroalcohólicos al 80 % de Malva sylvestris y Malva pseudolavatera a las concentraciones de 100, 200, 300, 400 y 500 μg/mL.
Preparación de la solución ABTS•+
El ensayo fue basado en la habilidad de diferentes sustancias de secuestrar el radical catiónico ABTS•+, el cual fue preparado mezclando una solución de ABTS 7mM y persulfato de potasio 2,45 mM (1/1, v/v). La mezcla se mantuvo en la oscuridad por 16 horas para la formación del radical. La solución ABTS•+ fue diluida con etanol al 96 % hasta lograr una absorbancia de 0,700 ± 0,05 a 734nm.
Evaluación de la actividad antioxidante
Se tomaron 980 µL de la solución de ABTS•+ radicálico con 20 µL de los extractos ensayados y la sustancia de referencia (ácido ascórbico) a las concentraciones de 100, 200, 300, 400 y 500 μg/mL. Se incubó por 30 min para su posterior lectura a 734 nm en un espectrofotómetro UV- visible. Cada determinación se llevó a cabo por triplicado.
Los resultados se expresaron como porcentaje de inhibición del radical ABTS•+ según la fórmula siguiente:
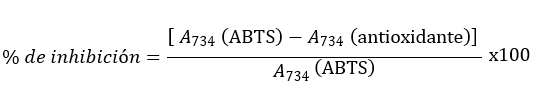
RESULTADOS
Recolección de datos
A continuación, se detalla los resultados obtenidos mediante la evaluación de la actividad antibacteriana y antioxidante de los extractos de la M. sylvestris y M. pseudolavatera.
Resultados: Actividad antibacteriana
En la figura 8; figura 20; tabla 1; tabla 2, se muestran los resultados de los dos extractos estudiados (acuoso e hidroalcohólico) para evaluar la actividad antibacteriana de Malva sylvestris y Malva pseudolavatera contra E. coli, S. aureus y K. pneumoniae.
Malva sylvestris
Extracto acuoso
En la evaluación de la actividad antibacteriana del extracto acuoso en el cual se realizó a partir de tres concentraciones (2,5 %, 5 % y 10 %) contra E. coli, S. aureus y K. pneumoniae. Se demostró que en ninguna de las tres concentraciones evaluadas frente a E. coli y S. aureus inhibió el crecimiento de los microorganismos utilizados, pero si presenta una mínima inhibición del crecimiento bacteriano de K. pneumoniae en la concentración 5 % presentando un halo de 8 mm. y en la concentración al 10 % se obtuvo un halo de 7mm. Resultados que se reflejan en la figura 8.
En cuanto los diámetros obtenidos de los halos de inhibición del control positivo utilizado en este caso fue Cefotaxima, están dentro de los patrones estándar de halo de inhibición establecidos por NCCLS, 2000.
Fuente: Abrigo & Goyes, 2019
Figura 8. Valores de halo de inhibición del extracto acuoso de M. sylvestris y controles
A continuación, se presentan fotografías más representativas de los resultados obtenidos del extracto acuoso de Malva sylvestris frente a cada microorganismo.
Escherichia coli
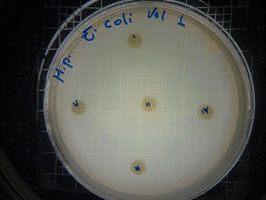
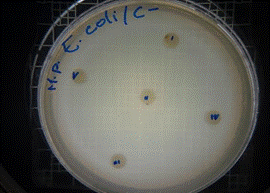
En las figuras 9 – 12, se puede observar los resultados de los antibiogramas obtenidos de los extractos acuosos de Malva sylvestris en las concentraciones de 2,5 – 5 y 10 %, frente a Escherichia coli, en el cual no se presenta ningún halo de inhibición, es decir que los extractos acuosos de Malva sylvestris a las tres concentraciones de estudio no presentan actividad antibacteriana contra Escherichia coli en comparación con el antibiótico de referencia.
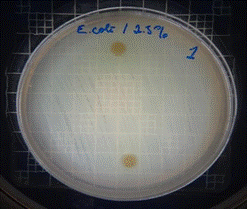
Figura 9. Antibiograma E. coli – M. sylvestris – extracto acuoso 2,5 %
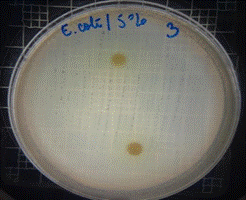
Figura 10. Antibiograma E. coli – M. sylvestris – extracto acuoso 5 %

Figura 11. Antibiograma E. coli – M. sylvestris – extracto acuoso 10 %
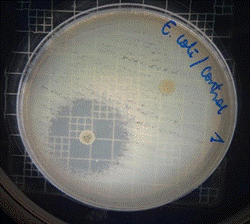
Figura 12. Antibiograma E. coli – M. sylvestris – Controles
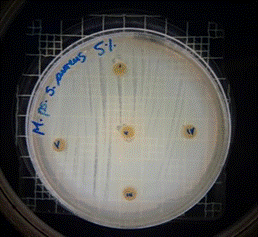
Staphylococcus aureus
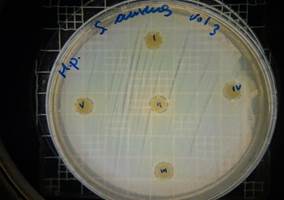
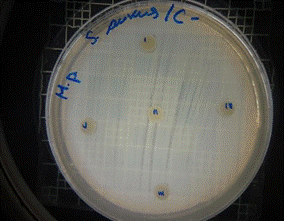
En las figuras 13 – 16, se reflejan los resultados obtenidos de los antibiogramas de los extractos acuosos de Malva sylvestris en las concentraciones de 2,5 – 5 y 10 %, frente a Staphylococcus aureus, en el cual se observan que no se presenta ningún algo de inhibición, es decir que los extractos acuosos de Malva sylvestris a las concentraciones de 2,5 – 5 y 10 %, no presentan actividad antibacteriana contra Staphylococcus aureus en comparación con el antibiótico de referencia.
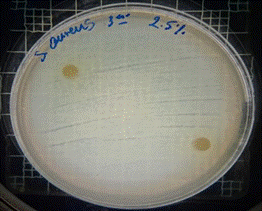
Figura 13. Antibiograma S. aureus – M. sylvestris – extracto acuoso 2,5 %
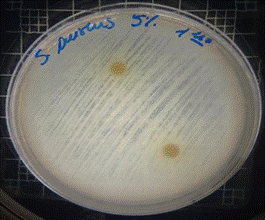
Figura 14. Antibiograma S. aureus – M. sylvestris – extracto acuoso 5 %

Figura 15. Antibiograma S. aureus – M. sylvestris – extracto acuoso 10 %
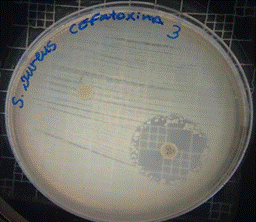
Figura 16. Antibiograma S. aureus – M. sylvestris – extracto acuoso – Controles
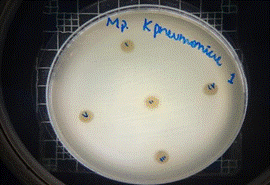
Klebsiella pneumoniae
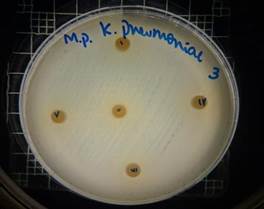
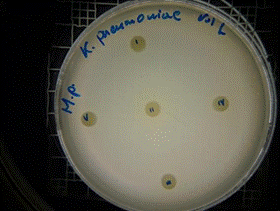
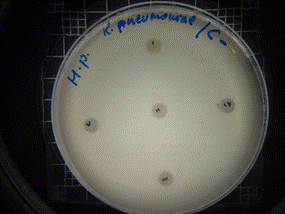
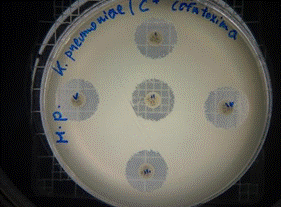
En las figuras 17 – 19, se observa los resultados obtenidos de los antibiogramas de los extractos acuosos de Malva sylvestris en las concentraciones de 2,5 – 5 y 10 % en réplicas de cinco, frente a Klebsiella pneumoniae, en la concentración de 5 % presenta halo de inhibición de 8 mm y en la concentración de 10 % presenta halo de inhibición de 7 mm, es decir que los extractos acuosos de Malva sylvestris a las concentraciones de 5 y 10 %, presentan una moderada actividad antibacteriana contra Klebsiella pneumoniae en comparación con el antibiótico de referencia.
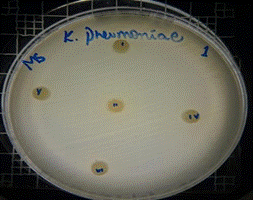
Figura 17. Antibiograma K. pneumoniae - M. sylvestris – extracto acuoso 2,5 %
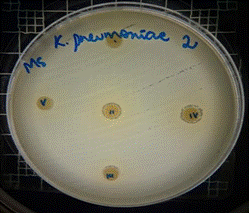
Figura 18. Antibiograma K.pneumoniae - M. sylvestris - extracto acuoso 5 %
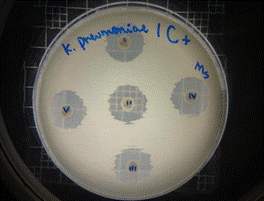
Figura 19. Antibiograma K. pneumoniae - M. sylvestris - extracto acuoso - Control +
Extracto hidroalcohólico
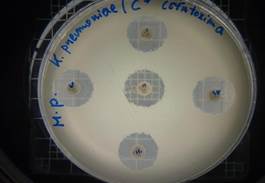
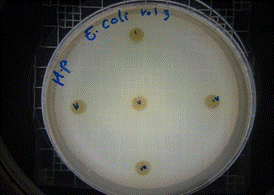
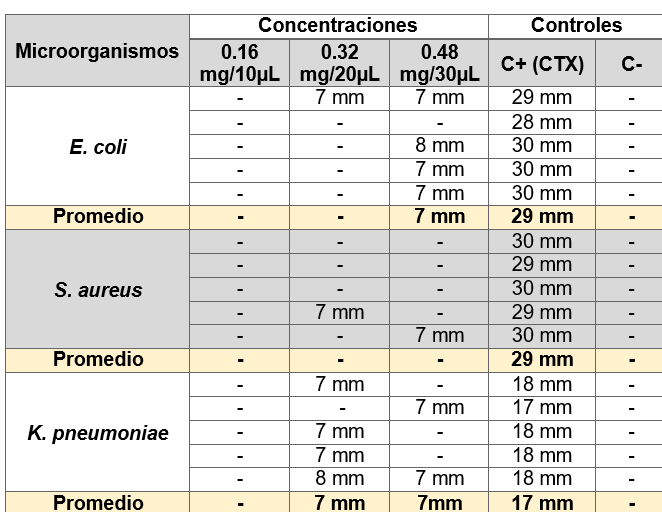
Para la evaluación de la actividad antibacteriana del extracto hidroalcohólico de Malva sylvestris se determinó en tres concentraciones diferentes (0,16 mg/10µL – 0,32 mg/20µL y 0,48 mg/30µL) contra E. coli, S. aureus y K. pneumoniae. Se demostró que a la concentración de 0,16mg/10µL del extracto no presentó inhibición de crecimiento microbiano de ninguno de los microorganismos mencionados, a la concentración de 0,32mg/20µL presentó una modera actividad contra Klebsiella pneumoniae con un halo de 7 mm, y a la concentración de 0,48mg/30µL presentó una moderada actividad de inhibición contra Escherichia coli y Klebsiella pneumoniae, mostrando halos de 7 mm (figura 20).
Los diámetros obtenidos de los halos de inhibición del control positivo utilizado fue Cefotaxima, y están dentro de los patrones estándar de halo de inhibición establecidos por NCCLS, 2000.
Fuente: Abrigo & Goyes, 2019
Figura 20. Valores de halo de inhibición del extracto hidroalcohólico de M. sylvestris y Controles
A continuación, se presentan imágenes más representativas de los resultados obtenidos del extracto hidroalcohólico de Malva sylvestris.
Escherichia coli
En las figuras 21 – 25, se reflejan los resultados obtenidos del extracto hidroalcohólico de Malva sylvestris frente a Escherichia coli, en el cual solo presenta una moderada actividad de inhibición en la concentración 0,48mg/30µL con un halo de 7 mm.
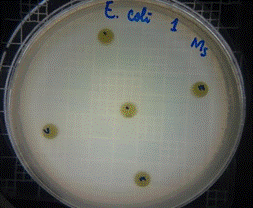
Figura 21. Antibiograma E. coli – M. sylvestris – Extracto Hidroalcohólico 0,16mg/10µL
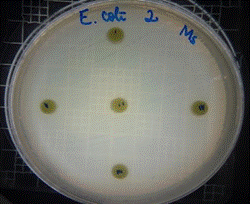
Figura 22. Antibiograma E. coli – M. sylvestris - Extracto Hidroalcohólico 0,32mg/20µL
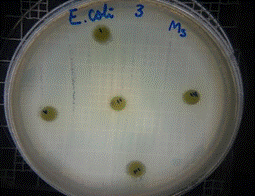
Figura 23. Antibiograma E. coli – M. sylvestris – Extracto Hidroalcohólico 0,48mg/30µL
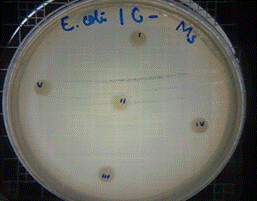
Figura 24. Antibiograma E. coli – M. sylvestris –Extracto Hidroalcohólico(Control)

Figura 25. Antibiograma E. coli – M. sylvestris – Extracto Hidroalcohólico (Control +)
Staphylococcus aureus
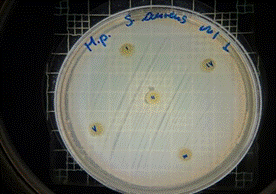
En las figuras 26 – 29, se reflejan los resultados obtenidos del extracto hidroalcohólico de Malva sylvestris frente a Staphylococcus aureus, en el cual no presenta actividad de inhibición en ninguna concentración.
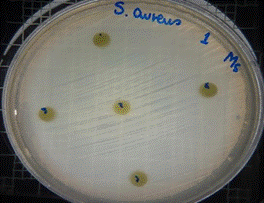
Figura 26. Antibiograma S. aureus M. sylvestris – Extracto Hidroalcohólico 0,16mg/10µL
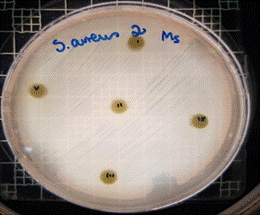
Figura 27. Antibiograma S. aureus M. sylvestris – Extracto Hidroalcohólico 0,32mg/20µL
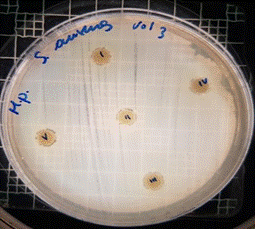
Figura 28. Antibiograma S. aureus M. sylvestris – Extracto Hidroalcohólico 0,48mg/30µL

Figura 29. Antibiograma S. aureus M. sylvestris – Extracto Hidroalcohólico (Control+)
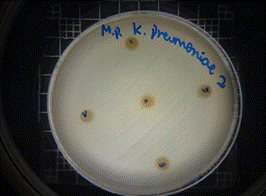
Klebsiella pneumoniae
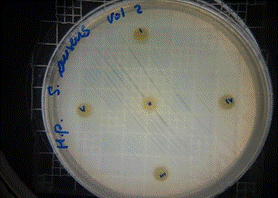
En las figuras 30 – 33, se reflejan los resultados obtenidos del extracto hidroalcohólico de Malva sylvestris frente a Klebsiella pneumoniae, en el cual no presenta actividad de inhibición en la concentración 0,16mg/10µL, pero si presenta actividad moderada en las concentraciones 0,32mg/20µL y 0,48mg/30µL, mostrando halos de 7 mm.
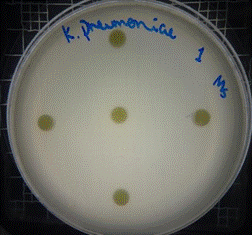
Figura 30. Antibiograma K. pneumoniae – M. sylvestris – Extracto Hidroalcohólico 0,16mg/10µL

Figura 31. Antibiograma K. pneumoniae –M. sylvestris – Extracto Hidroalcohólico 0,32mg/20µL

Figura 32. Antibiograma K. pneumoniae – M. sylvestris – Extracto Hidroalcohólico 0,48mg/30µmL
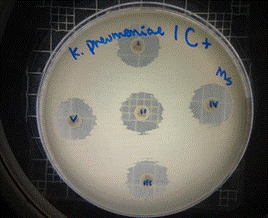
Figura 33. Antibiograma K. pneumoniae –M. sylvestris – Extracto Hidroalcohólico (Control+)
Malva pseudolavatera
Extracto acuoso
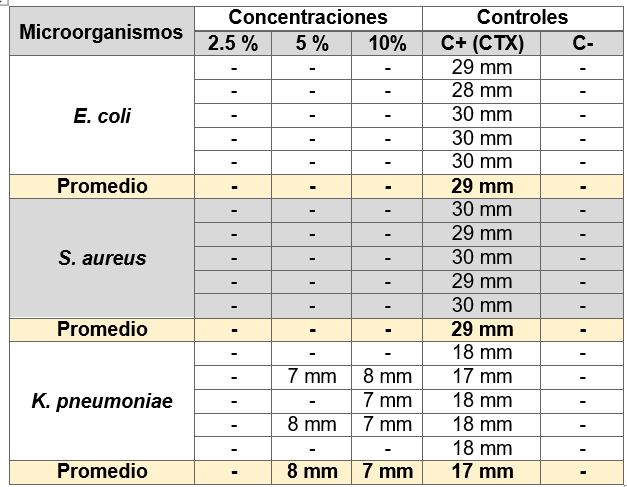
Los resultados obtenidos por el método de Kirby-Bauer o difusión en disco, demostraron que las bacterias gram-negativas (E.coli y K. pneumoniae) y gram-positivas (S. aureus) no presentaron halos de inhibición, en ninguna de las concentraciones (2,5 %, 5 %, 10 %) de los extractos acuosos analizados. Se consideró como control positivo cefotaxima y como control negativo el agua destilada. Los resultados obtenidos se muestran en la tabla 1.
|
Tabla 1. Valores de halo de inhibición del extracto acuoso de M. pseudolavatera y controles |
|||||
|
Microorganismos |
Concentraciones |
Controles |
|||
|
2,5 % |
5 % |
10 % |
C+ (CTX) |
C- |
|
|
E. coli |
- |
- |
- |
30 mm |
- |
|
- |
- |
- |
29 mm |
- |
|
|
- |
- |
- |
30 mm |
- |
|
|
- |
- |
- |
30 mm |
- |
|
|
- |
- |
- |
30 mm |
- |
|
|
Promedio |
- |
- |
- |
29,8 mm |
- |
|
S. aureus |
- |
- |
- |
30 mm |
- |
|
- |
- |
- |
28 mm |
- |
|
|
- |
- |
- |
29 mm |
- |
|
|
- |
- |
- |
30 mm |
- |
|
|
- |
- |
- |
28 mm |
- |
|
|
Promedio |
- |
- |
- |
29 mm |
- |
|
K. pneumoniae |
- |
- |
- |
18 mm |
- |
|
- |
- |
- |
17 mm |
- |
|
|
- |
- |
- |
18 mm |
- |
|
|
- |
- |
- |
18 mm |
- |
|
|
- |
- |
- |
18 mm |
- |
|
|
Promedio |
- |
- |
- |
17,8 mm |
- |
|
Fuente: Abrigo & Goyes, 2019 |
|||||
A continuación, se presentan imágenes más representativas de los resultados obtenidos del extracto acuoso de Malva pseudolavatera.
Escherichia coli
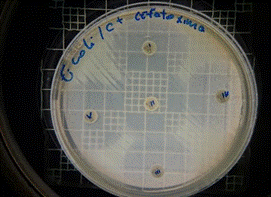
De acuerdo a los resultados obtenidos, en el antibiograma realizado con el extracto acuoso de Malva pseudolavatera frente a la cepa de E.coli se puede apreciar que no hubo halos de inhibición en ninguna de las concentraciones evaluadas (figuras 34, 35, 36); mientras que con el antibiótico (cefotaxima) utilizado como control positivo frente a la misma cepa, se pueden observar los respectivos halos de inhibición (figura 37).
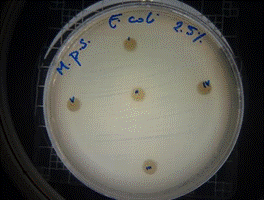
Figura 34. Antibiograma E. coli M. pseudolavatera - E. acuoso 2,5 %
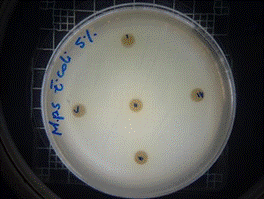
Figura 35. Antibiograma E. coli M. pseudolavatera - E. acuso 5 %
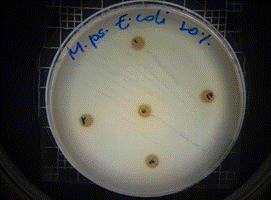
Figura 36. Antibiograma E. coli M. pseudolavatera - E. acuoso 10 %

Figura 37. Antibiograma E. coli M. pseudolavatera - E. acuoso (Control+)
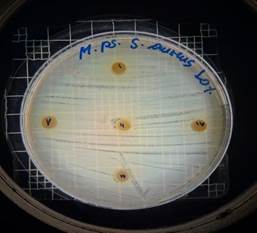
Staphylococcus aureus
De acuerdo con los resultados obtenidos, en el antibiograma realizado con el extracto acuoso de Malva pseudolavatera frente a la cepa de S. aureus se puede apreciar que no hubo halos de inhibición en ninguna de las concentraciones evaluadas (figuras 38, 39, 40); mientras que con el antibiótico (cefotaxima) utilizado como control positivo frente a la misma cepa, se pueden observar los respectivos halos de inhibición (figura 41).
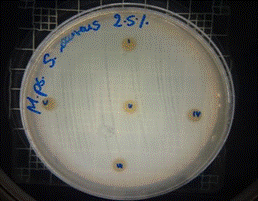
Figura 38. Antibiograma S. aureus M. pseudolavatera - E. acuoso 2,5 %