doi: 10.56294/hl2024.522
ORIGINAL
Antimicobial susceptibility profiles of Gram positive cocci isolated from bacteremia in pediatric patients
Perfiles de susceptibilidad antimicrobiana de cocos Gram positivos aislados de bacteriemias en pacientes pediátricos
Noel Suarez
Reyes1 ![]() *, Miguel Luis González Martínez1
*, Miguel Luis González Martínez1
![]() *, Kirenia Apaulaza Corrales1
*, Kirenia Apaulaza Corrales1
![]() *, Diana Lobo Riverol1
*, Diana Lobo Riverol1
![]() *, Leidy Liana López Ramos1
*, Leidy Liana López Ramos1
![]() *
*
1Universidad de Ciencias Médicas de Pinar del Rio. Cuba.
Citar como: Suarez Reyes N, González Martínez ML, Apaulaza Corrales K, Lobo Riverol D, López Ramos LL. Antimicobial susceptibility profiles of Gram positive cocci isolated from bacteremia in pediatric patients. Health Leadership and Quality of Life. 2024; 3:.522. https://doi.org/10.56294/hl2024.522
Enviado: 07-04-2024 Revisado: 22-07-2024 Aceptado: 07-11-2024 Publicado: 08-11-2024
Editor: PhD.
Prof. Neela Satheesh ![]()
Autor para la correspondencia: Noel Suarez Reyes *
ABSTRACT
Inections in pediatric ages arouse great concer both in family members and in the medical personnel who care for them. This is due to the serious prognosis of some of them in relation to survival and possible sequelae. The objective of ths research was to determine the profiles of antimicrobial susceptibility and multiresistance patterns were established in Gram positive cocci in blood culture from patients hospitalized at the Pepe Portilla Pediatric Teaching Hospital in Pinar del Rio from January to june 2021. An observational, descriptive and cross-sectional study was carried out with a universe consisting of 433 patients of pediatric ages, of which only 44 blood cultures (10,16 %) were positive for Gram positive cocci. All variables were processed through a descriptive analysis where the number (nº) and percentage (%) were determined through the SPSS package. It was found that Staphylococcus epidermidis showed the highest percentage (77,3 %) followed by Staphylococcus aureus (16,9 %), Enterococcus spp (4,5 %) and Streptococcus pneumoniae (2,3 %). Vancomycin, linezolid and teicoplanin showed the highest profiles of antimicrobial susceptibility to Gram positive cocci isolated in blood cultures in contrast to the generally decreased sensitivity to first generation penicillins and cephalosporins. 39,55 % of the Gram positive cocci isolated in bacteriemia showed some pattern of multidrugresistant microorganisms (MDR) represent 25 % of the isolates.
Keywords: Bacteremia; Staphylococcus; Multidrug Resistance.
RESUMEN
Las infecciones en edades pediátricas despiertan una gran preocupación tanto en los familiares como en el personal de salud que lo atiende. Esto se debe al grave pronóstico de algunas de ellas en relación con la supervivencia y a las posibles secuelas. Como objetivo de esta investigación se determinaron los perfiles de susceptibilidad antimicrobiana y se establecieron los patrones de multirresistencia en cocos Gram positivos procedentes de bacteriemias aislados en hemocultivo de pacientes hospitalizados en el Hospital Docente Pediátrico “Pepe Portilla” de Pinar del Rio desde enero a junio 2021,. Se realizó un estudio observacional, descriptivo y transversal con un universo constituido por 433 pacientes comprendidos en edades pediátricas de las cuales solo 44 hemocultivos 10,16 % resultaron positivos a cocos Gram positivos. Todas las variables fueron procesadas a través de un análisis descriptivo donde se determinó el número (n°) y porcentaje (%) a través del paquete SPSS. Se encontró que los Staphylococcus epidermitis mostraron el mayor porciento (77,3 %) seguidos del Staphylococcus aureus (15,9 %), Enterococos spp. (4,5 %) y Streptococcus pneumoniae (2,3 %). La Vancomicina, Linezolid y Teicoplanina mostraron los mayores perfiles de susceptibilidad antimicrobiana
a cocos Gram positivos aislados en hemocultivo en contraposición a la sensibilidad disminuida de forma general a las penicilinas y cefalosporinas de primera generación. El 29,55 % de los cocos Gram positivos aislados en bacteriemia mostraron algún patrón de multirresistencia y dentro de estos, los organismos multidrogorresistentes (MDR) representan el 25 % de los aislamientos.
Palabras clave: Bacteriemia; Staphylococcus; Multidrogorresistencia.
INTRODUCCIÓN
Desde el surgimiento de la medicina, ésta enfrentó un obstáculo que aún le ha sido imposible vencer en su totalidad: las infecciones.(1,2) El ingreso a un hospital presenta un riesgo de contraer una infección nosocomial en 5 a 10 % y la estancia en una Unidad de Cuidados Intensivos (UCI) incrementa este riesgo en 20 a 40 %; por lo que el uso de antibióticos es un tratamiento habitual en el paciente hospitalizado.Los antibióticos son la principal herramienta terapéutica con que cuenta el personal de salud para enfrentar las patologías infecciosas.(3,4,5) Su valor es indiscutible, no obstante, la resistencia creciente de los microorganismos a estos agentes, incluyendo los de amplio espectro, ha generado una dificultad de amplias dimensiones y representa en la actualidad un desafío terapéutico.(6,7,8,9)
El término de resistencia bacteriana, incluye toda la capacidad que tienen las bacterias de soportar los efectos de los antibióticos, es decir, la aparición de cepas refractarias al efecto bactericida o bacteriostático. Las cepas resistentes, son las que predominan por la presión selectiva de los antimicrobianos,(10) proceso que se ve acelerado por el mal uso y el abuso de los antibióticos tanto en humanos como animales.(11,12) Sin embargo, los antibióticos no solo matan a las bacterias sensibles y seleccionan a las resistentes, sino que también pueden contribuir directamente con los mecanismos de variación genética (mutación, recombinación, transposición, intercambio de genes).(13,14,15)
Debido que las bacterias resistentes pueden estar presentes en personas, animales y medio ambiente (agua, suelo y aire), utilizando diferentes mecanismos de transmisión para propagarse, la Organización Mundial de la Salud (OMS) reevalúa el problema de la resistencia a los antimicrobianos en las bacterias patógenas como una línea prioritaria de actuación para mejorar la salud, dada la diseminación mundial de clones bacterianos resistentes y también de genes que confieren resistencia a las drogas antimicrobianas,(16,17,18) siendo entre tantos otros microorganismos, los cocos Gram positivos responsables de bacteriemias y múltiples infecciones, donde se comportan en ocasiones como resistentes o multirresistentes.(19,20,21)
Mucho se ha discutido de la mayor proporción de infecciones nosocomiales causadas por microorganismos.(22,23,24) Según un estudio de prevalencia publicado por el European Center for Diseases Control and Prevention (ECDC), la Escherichia coli (E.coli), Staphylococcus aureus (Staphylococcus aureus) y el Enterococcus spp son los patógenos más importante en la infección nosocomial,(25,26) incluyendo la bacteriemia.(27,28) Estos últimos también destacan por su perfil multirresistente, de ahí que el 41,2 % de los aislados que hoy se realizan evidencian la presencia de Staphylococcus aureus resistentes a la meticilina (SARM) y un 10,2 % de los Enterococos son resistente a la vancomicina.(29,30,31) Estados Unidos por su parte, demostró que los microorganismos Gram positivos y los hongos fueron los responsables del mayor número de casos de sepsis y bacteriemia, mientras en Cuba,(32,33,34) los servicios de neonatología revelaron que, de 368 aislamientos, 191 fueron Gram positivos (51,9 %) y solo 177 (48,1 %) de Gram negativos, así mismo las muestras biológicas de catéter, hemocultivo y secreción respiratoria, evidencian que los mayores porcientos de aislamientos se corresponden con Staphylococcus epidermidis, Staphylococcus aureus y Enterococos spp.(35,36,37,38)
Por lo tanto, es indispensable la existencia de un programa de vigilancia de la resistencia bacteriana,(39,40) que posibilite la identificación de fenotipos de resistencia antimicrobiana de las bacterias que circulan en la unidad pediátrica y tengan en cuenta los patrones de susceptibilidad antimicrobiana de las mismas, lo cual permitiría para médicos y demás profesionales sanitarios una conciliación en la política de antibióticos a emplear, que posibilite el uso más racional de la quimioterapia antimicrobiana.(41,42,43)
MÉTODO
Se realizó un estudio observacional, descriptivo y transversal, con el objetivo de caracterizar la resistencia antimicrobiana de cocos Gram positivos aislados en hemocultivo de pacientes hospitalizados en el Hospital Docente Pediátrico “Pepe Portilla” de Pinar del Rio desde enero a junio 2021.El universo estuvo constituido por 433 pacientes pediátricos . La muestra quedo conformada por 44 hemocultivos que resultaron positivos a cocos Gram positivos. Se confecciono una ficha de recolección de datos que incluyo además de la indicación médica del examen los registros primarios del laboratorio de Microbiología.
Para la obtención y procesamiento de las muestras. Se entrevistó al padre o madre del paciente, al cual se le solicitó su consentimiento para participar en la investigación. La toma de muestra microbiológica para los diferentes procedimientos diagnósticos, se realizó por un especialista del laboratorio de Microbiología. En todos los casos se cumplieron los protocolos de asepsia y antisepsia recomendadas, así como el proceder de toma de muestra indicada para el sitio de aislamiento en estudio. Se extrajo 3 ml de sangre del paciente por venopunción y para llegar al diagnóstico microbiológico por parte del investigador principal, se siguió la marcha técnica propuesta por Koneman. La muestra biológica se inoculo en medios de cultivo específicos, se incubo a 37ºC por un tiempo de hasta 7 días con siembras seriadas en agar chocolate a las 24, 72 horas y 7 días y finalmente la observo la presencia o no de crecimiento de microorganismos.
Se comprobaron las características culturales del crecimiento y se procedió a realizar coloración de Gram para observar al microscopio óptico las características morfológicas y tintoriales. Se escogieron los cultivos que se corresponden con los microorganismos en estudio y se procedió a su identificación según los procedimientos y normativas técnicas vigentes y las implementadas en los talleres nacionales de vigilancia de fenotipos resistentes. Además como principio general se tuvo en cuenta suspender cualquier tratamiento con antibióticos 48 horas antes de la toma de muestra, para evitar reducción de la representación de microorganismos en los exámenes microscópicos y aislados en los cultivos. Se identificaron todas las cepas sugestivas de cocos Gram positivos que aparecieron en el medio de cultivo Agar chocolate, se les realizó examen microscópico con tinción de Gram, seleccionando para la siguiente etapa de identificación los que tuvieron la siguiente morfología y carácter tintorial: cocos Gram Positivos agrupados en racimos, en cadenas o en duplas. Las colonias así obtenidas se subcultivaron en una cuña de agar nutriente o agar chocolate para su conservación y utilización posterior. El diagnostico microbiológico se realizó a través de lo referido por MacFaddin.
Para la identificación del género Staphyilococus se llevaron a cabo diferentes pruebas bioquímicas, estas se realizaron en el laboratorio y permitió llegar al diagnóstico, donde se tuvo en cuenta la capacidad de producir catalasa, enzima que lo diferencia del género Estreptococcus (negativa). De igual manera se realizó la prueba de la coagulasa, la cual permitió diferenciar a los estafilococos coagulasa positivo del grupo de los estafilococos coagulasa negativos, a su vez Staphyilococus epidermidis (coagulasa negativa) es sensible a novobiocina y esto lo diferencia de especies similares resistentes a él como Staphylococcus saprophyticus. Para la identificación de Streptococcus pneumoniae y de Enterococcus spp a partir de colonias sugestivas y con una tinción de Gram, se observaron cocos Gram positivos agrupados en duplas, arriñonados, lanceolados o en cadenas cortas. Se les realizó las pruebas bioquímicas correspondientes como crecimiento en cloruro de sodio al 6,5 %, crecimiento en agar bilis-esculina al 40 %, siendo estas positivas para los Enterococcu spp y negativa para el Streptococcus pneumoniae y la prueba de sensibilidad a la optoquina y solubilidad en bilis al 10 %, esta última positiva para el Streptococcus pneumoniae.
Finalmente, se realizó la determinación de la susceptibilidad antimicrobiana in vitro, para lo cual se utilizó la técnica de difusión en agar por diseminación superficial en placa (Bauer-Kirby) y su interpretación estuvo basada en las normas recomendadas por el CLSI así como el E-test de Vancomicina para determinar la susceptibilidad para este antibiótico.
La determinación de la sensibilidad antibiótica se realizó mediante el método de difusión con discos en agar Muller-Hinton (o Agar sangre de carnero al 5 % para algunos Estreptococos y Enterococos). Este procedimiento nos permito hacer la siguiente interpretación:
· Sensible: el aislamiento cuyo crecimiento alrededor del disco antibiótico, no sobrepasa los límites determinados como sensible, comparados con los previsto por el CLSI.
· Intermedio: el aislamiento cuyo crecimiento tiene halos de inhibición situados en los rangos intermedios de sensibilidad para dicho antibiótico, o presenta un segundo halo inhibitorio dentro del rango intermedio.
· Resistente: el aislamiento cuyo crecimiento tiene halos de inhibición situados en los rangos de resistencia previstos por CLSI, o cubre absolutamente todo el espacio alrededor del disco antibiótico
Los antibióticos evaluados y su concentración fueron: Oxacilina (1ug), Cefoxitina (30 ug), Ciprofloxacina (5 ug), Eritromicina (15 ug), Clindamicina (2 ug), Penicilina (10 ug), Cefalexina (30ug) Amikacina (AK) (30 ug), Cefazolina (KZ) (30 ug) Cefotaxima (30 ug), Cefuroxima (30 ug), Rocephin (30 ug), Meropenen (10 ug), Linezolid (30 ug), Teicoplanina (30 ug), Cefepime (30ug) y Levofloxacino (10ug). Después de 24 h de incubación en aerobiosis a 35 °C, se determinó el diámetro de los halos de inhibición, con regla milimétrica.
Aspectos éticos la investigación
El estudio se enmarcó dentro de los principios de la ética médica profesional. La información se conoció de forma resumida y con fines investigativos. Para el desarrollo de la investigación se realizaron intervenciones técnicas propias de los estudios para clínicos normalmente realizados a los pacientes, en donde se sospecha la presencia de una infección de cualquier tipo, bien estandarizadas dentro de los procedimientos de un Laboratorio de Microbiología, por lo que no constituyo ningún daño a personas, familiares, ni la institución, sustentado en los principios estipulados por el comité de ética médica.
Procesamiento estadístico
El análisis y registro de la información de las variables se realizó un estudio descriptivo través de la distribución de frecuencias absolutas y relativas. Se empleó la prueba de independencia basada en la distribución de Chi cuadrado, tomando en cuenta un nivel de significación (α)= 0,05, en la determinación de número (n°) y porcentaje (%) de cepas resistentes a los antimicrobianos, se utilizó el programa WhonetTM Versión 5,6 (Word Health Organization). Además, se construyeron tablas y gráficos estadísticos para una mejor ilustración e interpretación de los resultados a partir de las salidas generadas por el programa Statistical Package for Social Sciences (SPSS) versión 26.0.
Aspectos de Bioseguridad
La investigación fue enmarcada dentro de los principios contenidos en el Programa Provincial de Medio Ambiente y Desarrollo, sustentada en la legislación ambiental vigente cuya expresión más reciente lo constituye la Ley No.81 de Medio Ambiente, y en materia de Bioseguridad, el Decreto Ley 190, el cual integra los principios que rigen las normas básicas para el trabajo e incluye las buenas prácticas del laboratorio: el uso de los medios de protección individual y colectiva, el tratamiento correcto de desechos biológicos peligrosos y el suplemento de las normas de esterilización y desinfección.
RESULTADOS
A continuación ofrecemos los siguientes resultados encontrados en la investigación que abalan el cumplimiento de los objetivos propuestos.
|
Tabla 1. Frecuencia de hemocultivos positivos a cocos Gram positivos por meses |
|||
|
Meses |
Total |
Positivos |
(%) |
|
Enero |
72 |
12 |
16,6 |
|
Febrero |
65 |
8 |
12,3 |
|
Marzo |
63 |
6 |
9,5 |
|
Abril |
75 |
7 |
9,3 |
|
Mayo |
91 |
8 |
8,8 |
|
Junio |
67 |
3 |
4,5 |
|
Total |
433 |
44 |
61 |
|
Tabla 2. Frecuencia de microorganismos aislados de hemocultivos |
||
|
No |
% |
|
|
Staphylococcus aureus |
7 |
15,9 |
|
Staphylococcus epidermidis |
34 |
77,3 |
|
1 |
2,3 |
|
|
Enterococos spp |
2 |
4,5 |
|
Nota: (n = 44) |
||
|
Tabla 3. Frecuencia de susceptibilidad del género Staphylococcus frente a los antibióticos más usados |
||||||
|
Antibiótico |
Sensible |
Intermedio |
||||
|
n |
% |
n |
% |
n |
% |
|
|
P |
14 |
34,15 |
6 |
14,63 |
21 |
|
|
AMP |
28 |
2 |
4,88 |
11 |
||
|
OX |
32 |
78,05 |
0 |
0 |
9 |
21,95 |
|
AMS |
26 |
63,41 |
2 |
4,88 |
13 |
31,71 |
|
AUG |
34 |
82,93 |
1 |
2,44 |
6 |
14,63 |
|
KZ |
30 |
2 |
4,88 |
9 |
21,95 |
|
|
CXM |
34 |
82,93 |
1 |
2,44 |
6 |
14,63 |
|
FOX |
35 |
85,37 |
0 |
0 |
6 |
|
|
CRO |
32 |
78,05 |
0 |
0 |
9 |
21,95 |
|
CTX |
33 |
80,49 |
1 |
2,44 |
7 |
17,07 |
|
FEP |
32 |
78,05 |
0 |
0 |
9 |
21,95 |
|
ATM |
32 |
78,05 |
0 |
0 |
9 |
21,95 |
|
MRP |
24 |
58,54 |
0 |
0 |
17 |
41,46 |
|
E |
26 |
63,41 |
4 |
9,76 |
11 |
26,83 |
|
AZM |
39 |
95,12 |
0 |
0 |
2 |
4,88 |
|
AK |
37 |
90,24 |
0 |
0 |
4 |
9,76 |
|
CD |
38 |
92,68 |
0 |
0 |
3 |
7,32 |
|
CIP |
31 |
75,61 |
3 |
7,32 |
7 |
17,07 |
|
LEV |
36 |
87,80 |
0 |
0 |
5 |
12,2 |
|
NOR |
38 |
92,68 |
0 |
0 |
3 |
7,32 |
|
LNZ |
41 |
100,00 |
0 |
0 |
0 |
0 |
|
VA |
40 |
97,56 |
0 |
0 |
1 |
2,44 |
|
TEC |
40 |
97,56 |
0 |
0 |
1 |
2,44 |
|
Nota: Ampicilina (AMP), Amoxacillina/sulbactan (AMS), Eritromicina (E), Levofloxacino (LEV), Augmentin (AUG), Azitromicina (AZM), Penicilina (P), Meropenem (MRP), Cefotaxime (CTX), Norfloxacina (NOR), Ceftriaxona (CRO), Cefuroxime (CXM), Cefazolina (KZ), Aztreonan (ATM), Cefepime (FEP), Ciprofloxacina (CIP), Cefoxitina (FOX), Clindamicina (CD), Amikacina (AK), Teicoplanina (TEC), Oxacillin (OX), Linezolid (LNZ), Vancomicina (VA) |
||||||
|
Tabla 4. Frecuencia de susceptibilidad del género Enterocococcus spp. frente a los antibióticos más usados |
||||||
|
Antibióticos |
Sensible |
Intermedio |
Resistente |
|||
|
n |
% |
n |
% |
n |
% |
|
|
E |
0 |
0 |
0 |
0 |
2 |
100 |
|
CIP |
1 |
50 |
0 |
0 |
1 |
50 |
|
AK |
2 |
100 |
0 |
0 |
0 |
0 |
|
TEC |
2 |
100 |
0 |
0 |
0 |
0 |
|
LNZ |
2 |
100 |
0 |
0 |
0 |
0 |
|
VA |
2 |
100 |
0 |
0 |
0 |
0 |
|
RIF |
2 |
100 |
0 |
0 |
0 |
0 |
|
Nota: Eritromicina (E), Ciprofloxacina (CIP), Amikacina (AK), Teicoplanina (TEC), Rifampicina (RIF), Linezolid (LNZ), Vancomicina (VA) |
||||||
|
Tabla 5. Frecuencia de susceptibilidad del Streptococcus pneumoniae frente a los antibióticos más usados |
||||||
|
Antibióticos |
Sensible |
Intermedio |
Resistente |
|||
|
n |
% |
n |
% |
n |
% |
|
|
P |
1 |
100 |
0 |
0 |
0 |
0 |
|
AMP |
1 |
100 |
0 |
0 |
0 |
0 |
|
OX |
1 |
100 |
0 |
0 |
0 |
0 |
|
AMS |
1 |
100 |
0 |
0 |
0 |
0 |
|
KZ |
1 |
100 |
0 |
0 |
0 |
0 |
|
CRO |
1 |
100 |
0 |
0 |
0 |
0 |
|
CTX |
1 |
100 |
0 |
0 |
0 |
0 |
|
MRP |
1 |
100 |
0 |
0 |
0 |
0 |
|
E |
1 |
100 |
0 |
0 |
0 |
0 |
|
AZM |
1 |
100 |
0 |
0 |
0 |
0 |
|
CD |
0 |
0 |
0 |
0 |
1 |
100 |
|
CIP |
0 |
0 |
0 |
0 |
1 |
100 |
|
LNZ |
1 |
100 |
0 |
0 |
0 |
0 |
|
VA |
1 |
100 |
0 |
0 |
0 |
0 |
|
Nota: Ampicilina (AMP), Amoxacillina/sulbactan (AMS), Eritromicina (E), Azitromicina (AZM), Penicilina (P), Meropenem (MRP), Clindamicina (CD), Cefotaxime (CTX), Ceftriaxona (CRO), Cefazolina (KZ), Oxacillin (OX), Ciprofloxacina (CIP), Linezolid (LNZ), Vancomicina (VA) |
||||||
|
Tabla 6. Patrones de multirresistencia de los cocos Gram positivos |
||
|
Patrones |
No |
% |
|
11 |
25,00 |
|
|
2 |
4,55 |
|
|
PDR |
0 |
0,00 |
|
Nota: Multidrogorresistentes (MDR), Extremodrogorresistente (XDR) y Pandrogorresistente (PDR) |
||
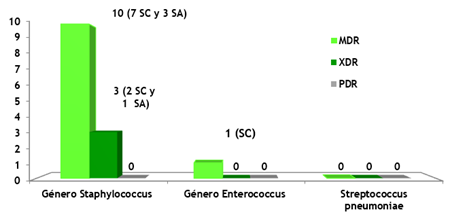
Figura 1. Patrones de multirresistencia de cocos Gram positivos según servicios de hospitalización
DISCUSIÓN
La tabla 1 muestra que, de 44 hemocultivos positivos, el 16,6 % se correspondió con el mes de enero, seguido de un 12,3 % correspondiente al mes de febrero.(44,45)
Esta mayor frecuencia de cocos Gram positivos aislados en hemocultivos correspondientes al mes de enero, pudiera estar dado a la colonización bacteriana secundaria que en ocasiones se genera a partir de una infección respiratoria viral.(46,47,48) Cabe aclarar que, aunque no se establecen particularidades en la literatura nacional e internacional sobre la estacionalidad del año frente a las bacteriemias, si está demostrado un incremento de las infecciones respiratorias virales en edades pediátricas durante los meses de invierno, que en muchos casos constituyen una puerta de entrada para la aparición y colonización bacteriana, lo cual pudiera generar una bacteriemia.(49,50,51)
Estudios en Cuba, afirman que las enfermedades respiratorias de origen viral se presentan con carácter epidémico entre los meses de septiembre a marzo, aunque pueden existir casos esporádicos a lo largo del año(52,53) con un pico máximo de presentación entre los meses de enero o febrero, resultados estos que pueden ser la causa inicial del mayor incremento de la frecuencia de hemocultivos positivos a cocos Gram positivos en los meses de enero y febrero.(54,55,56,57)
Diversos trabajos(58,59,60) evidencian un 10 % de afectación en los lactantes durante una epidemia por enfermedades respiratorias de origen viral, de los cuales entre el 15 y el 20 % de los casos requerían ingreso hospitalario.(61,62,63) Todos estos aspectos guardan relación con los resultados obtenidos, si tomamos como premisa la época de presentación de estas enfermedades respiratoria como vía de una futura instauración bacteriana.(64,65)
Otros autores(66) estimaron que del 80- 90 % de las infecciones respiratorias agudas son de causa viral y que las de origen bacteriano, de mucha menor frecuencia, están relacionadas con algunos cuadros específicos de infecciones respiratorias en la vía aérea superior.(67) A pesar de encontrarse a lo largo de todo el año, las de origen viral tienden a estacionarse y se presentan principalmente en las épocas frías, en forma de brotes epidémicos y son de duración e intensidad variables; asimismo, pueden producir infección inaparente o sintomática, de distintas extensión y gravedad, según diferentes factores, tales como: edad, sexo, contacto previo con el mismo agente infeccioso, alergias y estado nutricional.(68,69)
La tabla 2 muestra que Staphylococcus epidermidis resultó el de mayor frecuencia con un 77,3 % en los aislados de hemocultivos, seguidos del 15,9 % de Staphylococcus aureus, mientras las frecuencias más bajas se presentaron para Enterococcus spp. y Streptococcus pneumoniae. Datos basados de estudios epidemiológicos procedentes de redes de vigilancia en países desarrollados, entre ellos los Estados Unidos, muestran que hasta 60 % de las infecciones del torrente sanguíneo son causadas por este grupo de gérmenes, y que la seguridad terapéutica de los esquemas de antibióticos disponibles se ve amenazada por la emergencia de cepas resistentes, las cuales muestran un incremento progresivo con el paso de los años(70) resultados similares a los encontrados en este estudio fueron presentados por Espinosa quienes agregaron que dentro de las bacterias Gram positivas, los Staphylococcus aureus, Staphylococcus epidermidis y Enterococcus spp., representan los patógenos de mayor importancia en el medio ambiente hospitalario. Así mismo González reportaron que el Staphylococcus epidermidis fue el microorganismo más frecuente con 42 aislamientos, representando el 11,0 %.(71,72)
Investigaciones realizadas en Argentina(73) también coinciden con este estudio, a partir de los mayores reportes de aislamiento de Staphylococcus epidermidis y Enterococos spp. como patógenos Gram positivos causantes de sepsis neonatal y de bacteriemia. Por su parte diversos estudios señalan,(74) que el Staphylococcus epidermidis hoy en día constituye el microorganismo más frecuente en los servicios de neonatología, así como en los diversos departamentos de los hospitales pediátricos, lo cual sugiere el establecimiento de estrategia de control.Otros reportes como los del hospital del estado Zulia,(75) muestran una baja incidencia de microorganismos principalmente del género Enterococcus spp. en hemocultivos procesados. Con una reducción de 9,06 % en el año 2008 a un 4 % durante los años subsiguientes, siendo el Enterococcus faecium la especie más aislada (57,9 % del total de aislamientos del género), seguida por Enterococcus faecalis (37,7 %).(76,77)
La tabla 3 muestra los porcientos de susceptibilidad del género Staphylococcus frente a los diferentes antibióticos testados en el laboratorio y más usados en la práctica médica. Aspecto que pone de manifiesto la gran sensibilidad existente en estos grupos de microorganismos principalmente frente a los antibióticos de última generación como la vancomicina, linezolid, teicoplanina, no así con respecto a los de primera generación, quienes evidencian un mayor grado de resistencia.(78,79) Los mayores porcientos de sensibilidad de los Staphylococcus se correspondieron con el linezolid (100 %), seguido de la vancomicina (97,7 %) y teicoplanina (97,7 %), quienes a su vez mostraron los valores más bajos de resistencia.(80) Por su parte, la penicilina (34,15 %), eritromicina (63,41 %), trifamox (63,41) y ampicilina (68,29) y las cefalosporinas de primera generación como la cefazolina (73,17) fueron los menos sensibles y están asociadas a los mayores porcientos de resistencia como ocurrió con la penicilina (51,22 %), seguidos de la amoxacillina (31,71 %), ampicilina y eritromicina, estos últimos con un 26,83 % cada una. Resultados que coinciden con lo descrito en la literatura.(81)
Sin embargo, aunque no era de esperar, se observó una alta resistencia al meropenem (MRP) quien mostró un 41,46 %, resultados estos que pudieran estar dado además de una menor calidad de los discos utilizados, a los actuales mecanismos de resistencia(82) como los cambios en proteínas de la membrana externa, bombas de eflujo inespecíficas, producción de enzimas tipo β-lactamasa y modificaciones del sitio blanco, donde los tres primeros mecanismos han sido bien descritos en bacterias Gram negativas, mientras que el último en bacterias Gram positivas.(83)
Referido a la baja sensibilidad de forma general a las penicilinas, así como la presencia no despreciable de cepas con poca o ninguna sensibilidad a penicilinas con inhibidores y cefalosporinas de primera generación, están relacionados con los resultados obtenidos por González et al. quienes concluyeron que la Penicilina refleja los mayores porcientos de resistencia con un 81,15 % para los Gram positivos, aspecto que han sido confirmado.(84) En este sentido, aunque con menores valores, no se puede dejar de mencionar la resistencia mostrada de los Staphylococcus a la Cefoxitina (FOX), quien representó el 14,63 %. Resultados estos que están asociados a la función predictora que tiene la Cefoxitina de detectar resistencia a la meticilina (SARM)(85) y por ende al resto de los betalactámicos.
Como resultados de una creciente prevalencia de infecciones por SARM, tanto en los hospitales como en la comunidad, en la ciudad de Chicago, en su área metropolitana se reportó que entre 8-9 % de los pacientes ingresados eran portadores de SARM, mientras en Canadá, la tasa de pacientes infectados /colonizados por SARM en el 2003 fue de 5 x 10000.(86) Así mismo, existen reportes que hasta un 60 % de las infecciones por Staphylococcus aureus en las unidades de cuidados intensivos corresponden a SARM(87) y de las 25 cepas de SARM hospitalarias identificadas, 19 de ellas (76 %) fueron aisladas en pacientes ingresados en salas de atención al grave.Otros estudios, encontraron diferencias en cuanto a los patrones de resistencia de los SARM hospitalarios en relación con los SARM asociados a la comunidad. En el primer caso se reportan resistencias a macrólidos y aminoglucósidos, a diferencia de los aislamientos comunitarios que sí son sensibles a ambas familias de antibióticos, aunque comparten un espacio epidemiológico con clones multirresistentes.(88) En Cuba, no se observaron diferencias entre los patrones de resistencia de los SARM hospitalarios y comunitarios; en ambos casos se constataron valores de resistencia elevados frente a todos los antibióticos probados (Penicilina, eritromicina, tetraciclina, gentamicina, clorafenicol y sulfaprim), con excepción de vancomicina.
La frecuencia de susceptibilidad del género Enterocococcus frente a los antibióticos más usados evidenció un 100 % de sensibilidad para la amikacina, teicoplanina, rifampicina, linezolid y vancomicina, quienes a su vez no mostraron resistencia, no así para el caso de la eritromicina (0 %) y ciprofloxacina (50 %) quienes presentaron las frecuencias de sensibilidad más baja y una gran resistencia por parte de los Enterocococcus spp.
Sin embargo, pese a no encontrar resistencia a la vancomicina en este estudio. Cabe aclarar, que en la actualidad se han encontrado en otros estudios resistencia de Enterococcus spp a vancomicina y que las cepas resistentes son vigiladas epidemiológicamente, lo que ha generado preocupaciones, dado que a pesar de su baja capacidad patógena, presentan una alta capacidad adaptativa debido a la plasticidad de su genoma, una resistencia intrínseca a varios antibióticos y la gran habilidad de adquirir y diseminar genes de resistencia(89) que se pone de manifiesto a través de su mecanismo de resistencia en la adquisición de los genes vanA, responsables de la síntesis de precursores modificados de peptidoglucano (terminados en D-Ala-D-Lac) con reducida afinidad por el antibiótico. Los dos más frecuentes son el van A (que produce resistencia a vancomicina y teicoplanina) y el van B (resistente solo a vancomicina).(90)
La frecuencia de susceptibilidad del Streptococcus pneumoniae frente a los antibióticos más usados evidencian que, a excepción de la clindamicina y la ciprofloxacina, los restantes antibióticos mostraron un 100 % de sensibilidad, resultados estos que coinciden con lo publicado(91) donde aún se reconoce la sensibilidad a penicilina y cefotaxima.
Cabe aclarar que, aunque este estudio mostró gran sensibilidad para todos los antibióticos. En la actualidad, alrededor de un 20-30 % de los Streptococcus pneumoniae son resistentes a mucho de estos antibióticos(92) y, como se ha dicho anteriormente, las cepas resistentes a la eritromicina suelen mostrar resistencia cruzada con el resto de macrólidos y lincosamidas. Recientemente se ha descrito la aparición de resistencia en los Streptococcus pneumoniae a las quinolonas, definida como una CIM para el ciprofloxacino ≥ 4 μg/ml. Además, algunas de las nuevas quinolonas se han asociado a efectos adversos importantes, como toxicidad hepática y cardíaca.Otros estudios, revelan que la resistencia a la penicilina en los Streptococcus del grupo viridans (SGV), al igual que en Streptococcus pneumoniae, se debe exclusivamente, a alteraciones en una o más proteínas fijadoras de penicilina (PBP) con una afinidad reducida hacia este antibiótico y demás β-lactámicos.(93)
Las alteraciones en la PBP 3 y 4 son las que mayormente se observan en los SGV resistentes a la penicilina, mientras que las alteraciones en la PBP 2x son las que suelen asociarse con la sensibilidad disminuida a las cefalosporinas. La aparición de las alteraciones en las PBP puede ser el resultado de un desarrollo intrínseco (mutaciones), o bien de la adquisición de los determinantes genéticos de la resistencia, mediante procesos de recombinación homóloga y transferencia horizontal entre cepas de la misma especie o especies relacionadas.(94) Esta transferencia genética es especialmente notable entre Streptococcus pneumoniae y los SGV.
En la tabla 6 se presenta los patrones de multirresistencia de cocos Gram positivos aislados de hemocultivos. Como se puede observar, casi un 30 % de las muestras presentaron algún patrón de multirresistencia, entre las cuales un 25 % del total fueron MDR, seguidos de un 4,55 % de XDR.En tal sentido, la presencia de un 25 % correspondiente al patrón Multidrogorresistentes (MDR) obtenido en este estudio, se corresponde con lo reportado en la India (26,8 %), no así en Chile, Estados Unidos (86 % y 90 % respectivamente) y en un hospital de Maracaibo (45,07 %) quienes mostraron mayores porcientos.Cabe agregar, que durante los últimos años se ha observado un aumento en la incidencia de infecciones causadas por bacterias multidrogorresistentes (MDR), lo cual se ha convertido en un problema de salud pública en el mundo. Sin embargo, la prevalencia de cepas MDR es diferente en cada hospital y está relacionada con el tipo de pacientes, los procedimientos terapéuticos, el tipo de cirugías y las políticas para el uso de antibióticos y programas de prevención de infecciones asociadas con el cuidado de la salud.(95,96)
La figura 1 muestra que los mayores porcientos de aislamiento están asociado al patrón multidrogorresistente (MDR) correspondiente al género Staphylococcus con 10 aislamientos, de ellos siete en servicios cerrados y tres en abierto, seguido de un aislamiento en servicio cerrado para el género Enterococcus spp Resultados que ponen de manifiesto la alta resistencia adquirida de microorganismos en servicios cerrados de hospitalización.(97) Esta situación es preocupante, ya que existe mayor riesgo de infecciones durante la hospitalización con cepas MDR y como resultado de procedimientos invasivos.(98) Así mismo, se constató la presencia de un patrón extremodrogorresistente (XDR) correspondiente al género Staphylococcus con tres aislamientos, de ellos dos en servicios cerrados y uno en abierto. Resultados que están en correspondencia con lo reportado en Cuba(99) quienes evidenciaron que de ocho cepas (para 16 % del total de cultivos estudiados) presentaron una multirresistencia importante frente a cinco antimicrobianos de grupos farmacológicos diferentes.(100) El patrón de multirresistencia de los Enterococcus spp. mostró un predominio de los MDR con un caso en servicios cerrados de hospitalización, resultados que coinciden con los publicados por German en la Reunión Bienal Conjunta ReLAVRA/RILAA quien no solo encontró una mayor presencia de los MDR,(101) sino de los XDR.Estos resultados no coinciden con los obtenidos por Torres quienes encontraron 19 patrones de multirresistencia para el Streptococcus pneumoniae, dentro de estos, a cinco tipos de antibióticos: cotrimoxazol, penicilina, tetraciclina, eritromicina/azitromicina y clindamicina, presente en 44 cepas (7,7 %), seguido de resistencia solo a cotrimoxasol, penicilina y eritromicina/azitromicina, presente en 28 cepas (4,9 %).Por su parte, De la Osa-Busto observó resistencia a múltiples fármacos (MDR) en el 59,3 % de los aislados procedentes de países asiáticos.(102)
En este estudio la eritromicina mostró alta resistencia a SN 24 de ellas (51,06 %).(103) Un estudio realizado en Sevilla España en 2017 mostró que la proporción de cepas neumocócicas no sensibles a la Penicilina oral y resistentes a la Amoxicilina fue del 33 y 3 %, respectivamente.(104) La resistencia a la amoxicilina se asoció con la antibioterapia previa. Los serotipos 19A (8,2 %), 3 (6,2 %), y 6A (4,2 %) fueron los más destacados serotipos no PCV7 en la región de Asia.(105,106) Entre los aislados con el serotipo 19A, 86,0 % y 79,8 % mostraron resistencia a la eritromicina y MDR, respectivamente.(107) El impacto clínico de la resistencia antimicrobiana requiere el estudio de los mecanismos implicados con el fin de contribuir a una adecuación rápida del tratamiento, así como para el seguimiento y el control epidemiológico.(108) La emergencia y diseminación de resistencia puede ser controlada con apropiada higiene personal, adecuada disposición de excretas para prevenir la diseminación de bacterias multidrogo-resistentes (MDR), vigilancia de la población bacteriana local, intervención temprana, medidas rigurosas de control de infecciones cruzadas y uso adecuado de agentes antimicrobianos basados en los datos actuales de susceptibilidad local.(109,110)
CONCLUSIONES
El género Staphylococcus constituyo dentro de los cocos Gram positivos el más recuente aislado, siendo el Staphylococcus epidermidis la especies con mayor porciento de aislamiento.
Continúa siendo la sensibilidad a vancomicina, linezolid y teicoplanina los antibióticos com mayor susceptibilidad en cocos Gram positivos.
Se constató la presencia de patrones susceptibilidad disminuida de forma general a penicilinas y cefalosporinas de primera generación.
Casi un tercio de los cocos Gram positivos aislados presentó algún patrón de multirresistencia, un cuarto del total correspondió con la categoría multidrogorresistentes (MDR).
REFERENCIAS BIBLIOGRÁFICAS
1. Aguirre, Elisa., Céspedes, E., Rubal Alina de la C., Maza Amparo y Terán, C. A. 2014. Morbilidad por infecciones respiratorias agudas en menores de 5 años. MEDISAN:18(11):1490-1498
2. Alcaide F, Liñares J, Pallarés R, Carratalà J, Benítez MA, Gudiol F, Martín R. 1995. In vitro activities of twenty-two β-lactam antibiotics against penicillin-resistant and penicillin-susceptible viridans streptococci isolated from blood. Antimicrob Agents Chemother 1995; 39:2243-2247.
3. Alós, J. I. 2015. Resistencia bacteriana a los antibióticos: una crisis global. Enferm. Infecc. Microbiol. Clin., vol. 33, no. 10, pp. 692–699
4. Araneo J, Escudero FI, Arbizu MAM, Trivarelli CB, Dooren MCVD, Lichtensztejn M, et al. Wellness and Integrative Health Education Campaign by undergraduate students in Music Therapy. Community and Interculturality in Dialogue 2024;4:117–117. https://doi.org/10.56294/cid2024117.
5. Ardanuy Carmen., Cercenado Emilia., Morosini María Isabel y Torres Carmen. Detección fenotípica de mecanismos de resistencia en grampositivos. Recomendaciones de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica. 2011.Procedimientos en Microbiología Clínica
6. Ardiles-Irarrázabal R-A, Pérez-Díaz P, Pérez-González J-C, Valencia-Contrera M. Trait emotional intelligence as a damping factor in the face of post-pandemic lockdown academic exhaustion? Salud, Ciencia y Tecnología 2024;4:787–787. https://doi.org/10.56294/saludcyt2024787.
7. Arias CA, Murray BE. Emergence and management of drug-resistant enterococcal infections. Expert Rev Anti Infect Ther. 2008; 6:637-55. http://dx.doi.org/ 0.1586/14787210.6.5.637
8. Arias CA, Murray BE. The rise of the Enterococcus: Beyond vancomycin resistance. Nat Rev Microbiol. 2012; 10:266-78. http://dx.doi.org/10.1038/nrmicro2761
9. Auza-Santiváñez JC, Díaz JAC, Cruz OAV, Robles-Nina SM, Escalante CS, Huanca BA. Gamification in personal health management: a focus on mobile apps. Gamification and Augmented Reality 2024;2:31–31. https://doi.org/10.56294/gr202431.
10. Ballesté López I, González Ballesté M, Campo González A, Amador Morán R, Pérez Hernández B, Díaz Valdés YN. Resistencia de Staphylococcus aureus frente a cefalosporinas en la sepsis neonatal y puerperal. Rev Cuba Obstetr Ginecol [Internet]. 2019 [citado 8 Jun 2021];, 45(1):[aprox. 0 p.]. Disponible en: http://revginecobstetricia.sld.cu/index.php/gin/article/view/416
11. Begué Nuris., Goide, E., Frías, N., Domínguez, D., Leyva, R. 2015. Caracterización clínico epidemiológica de las infecciones asociadas a la atención sanitaria en niños y adolescentes. MEDISAN [revista en la Internet]. Ene [citado 2015 Oct 29]; 19(1): 4-9. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1029-30192015000100002&lng=es
12. Blanco, M., Scandizzo, E y González Y. 2011. Frecuencia de aislamientos microbiológicos en hemocultivos. RC HC. 10: 8-13
13. Bravo Laura y Jiménez, V. 2018. Resistencia antibiótica en Pseudomonas aeruginosa: situación epidemiológica en España y alternativas de tratamiento. Trabajo fin de grado. Facultad de Farmacia. Universidad Complutense. 23 p
14. Briceño Indira, Suárez Manuel E. 2006. Resistencia Bacteriana en la Unidad de Cuidados Intensivos del Hospital Universitario de Los Andes. Medicrit 2006 [Citado 2021 Oct 12]; 3(2) Disponible en: http://www.medicrit.com/Revista/v3n2.06/30030206.pdf
15. Cancino V, Garzon ML, Hansen A, Brusca maria I. Evaluation of the preference and recommendation of dentists regarding the use of bamboo toothbrushes. Odontologia (Montevideo) 2024;2:125–125. https://doi.org/10.62486/agodonto2024125.
16. Cancino V, Monteagudo A, Brusca MI, Baggini E, Ferreira AV. Assessment of the level of knowledge in dentists about the benefits of bamboo toothbrushes compared to conventional plastic ones. AG Salud 2024;2:121–121. https://doi.org/10.62486/agsalud2024121.
17. Cano AMC. The gentrification of health: an analysis of its convergence. Gentrification 2024;2:54–54. https://doi.org/10.62486/gen202454.
18. Cano CAG, Castillo VS. Scholarly Output on Computer Networks and Communication: A Ten-Year Bibliometric Analysis in Scopus (2013-2022). Gamification and Augmented Reality 2024;2:29–29. https://doi.org/10.56294/gr202429.
19. Capriott T. Supermicrobios resistentes crean la necesidad de nuevos antibióticos. Dermatol Nurs. 2007;19(1):65-70
20. Caquimbo GA, Virgilito A, Saldaña J. Functional aesthetic rehabilitation and its impact on self-esteem. Odontologia (Montevideo) 2024;2:126–126. https://doi.org/10.62486/agodonto2024126.
21. Caro SB, García M. Symbols in the field: a semiotic analysis of the football shields of bolívar city, colombia. Community and Interculturality in Dialogue 2024;4:138–138. https://doi.org/10.56294/cid2024138.
22. Cars, O., Hogberg, LD., Murray, M., Nordberg, O., Sivaraman, S., Lundborg, C.S. 2008. Meeting the callenge of antibiotic resistence. Br. Med. J. 337: 1438 http://preview.ncbi.nlm.nih.gov/pubmed?term=%22Cars%20O%22%5BAuthor%5D
23. Castellano-González MJ, Perozo-Mena AJ, Molero-Cubillán MdJ, Montero-Araujo SdC, Primera-Rodríguez FJ. Resistencia a la clindamicina inducida por eritromicina en cepas de Staphylococcus aureus de origen clínico. Kasmera 2015; 43: 34-45.
24. Céspedes-Proenza I, La-O-Rojas Y, García-Bacallao Y, Leyva-Samuel L, Padín-Gámez Y, Crispin-Rodríguez D. Educational intervention on oral cancer in high-risk patients over 35 years of age. Community and Interculturality in Dialogue 2024;4:127–127. https://doi.org/10.56294/cid2024127.
25. Claudio BAM. Application of Data Mining for the Prediction of Academic Performance in University Engineering Students at the National Autonomous University of Mexico, 2022. LatIA 2024;2:14–14. https://doi.org/10.62486/latia202414.
26. Collazos JV. The management of human talent in the new business landscape, from the analysis of strategies for recruitment, selection, and development. SCT Proceedings in Interdisciplinary Insights and Innovations 2024;2:238–238. https://doi.org/10.56294/piii2024238.
27. De la Osa-Busto M., Reyes-Hernández K.L., Reyes-Gómez U., Perea-Martínez A., Luévanos-Velázquez A., Hernández-Lira I., Sandoval-García M.S., Zempoalteca-Sánchez E., Saavedra-Cabrera S.L., Avila-Correa A. 2017. Sensibilidad antimicrobiana de cepas de Streptococcus pneumoniae. Período 2012-2015, en niños menores de 6 años que cursaron con neumonía. RevSalJal. 4 (3): 161-167
28. Demianchuk A, Hrymskyy V, Tsyhanyk M, Tymkiv B, Pidkova I. Analysis of scientific research on the sacred art of the Roman Catholic Church in Ukrainian territories. Salud, Ciencia y Tecnología - Serie de Conferencias 2024;3:.1234-.1234. https://doi.org/10.56294/sctconf2024.1234.
29. Durich, J. O. 2000. Resistencia bacteriana a los antibióticos. Med. Integr., vol. 36, pp. 367–370
30. Espinosa, C., Cortés, J., Castillo, J y Leal, A.L. 2011. Revisión sistemática de la resistencia antimicrobiana en cocos Gram positivos intrahospitalarios en Colombia. Biomédica. 31: 27-34
31. Espinosa, C.J., Cortés, J.A., Sebastián, J y Leal Aura. 2011. Revisión sistemática de la resistencia antimicrobiana en cocos Gram positivos intrahospitalarios en Colombia. Biomédica. 31:27-34
32. Espinosa-Jaramillo MT. Internal Control in Companies from the Perspective of the COSO. Management (Montevideo) 2024;2:28–28. https://doi.org/10.62486/agma202428.
33. Fenoll A. Jado I. Vicioso D, Pérez A, Casal J. Evolution of Streptococcus pneumoniae serotypes and antibiotic resistance in Spain: update (1990-1996). Journal of Clinical Microbiology 1998; 36:3447-3454.
34. Fish DN, Piscitelli SC, Daziger LH. Development of resistance during antimicrobial therapy: a review of antibiotic classes and patients characteristics in 173 studies. Pharmacotherapy 1995;15(3):279-91.
35. Fresnadillo, MJ., García, MI., García, E., García Sánchez, JE. 2010. Los carbapenems disponibles: propiedades y diferencias. Enferm. Infecc. Microbiol. Clin. 28 (2):53-64.
36. Ftaikhan AK, Al-Sharrad MA. Effect of Compaction Pressure on a Stabilized Rammed Earth Behavior. Salud, Ciencia y Tecnología - Serie de Conferencias 2024;3:821–821. https://doi.org/10.56294/sctconf2024821.
37. Galván-Meléndez MF, Galindo-Burciaga M, Alvarez-Meraz SL, Lozano-Cortes K, Lomas-Salinas NC. 2017. Prevalencia de los mi-croorganismos aislados en las infecciones nosocomiales en un hospital de México. Avan C Salud Med 2017; 4 (2): 46-51
38. García - Quintero Flavia y de la Cruz Rodríguez, R. 2018. Actualización en la etiopatogenia de la bronquiolitis aguda. Revista 16 de abril. 57 (268):125-134
39. García, B. M., Reijtman, V., Mastroianni, T. A., Taicz, D. M., Gómez, S., Hernández, B. C., Guitter, D. M., Felice, M. S y Pérez, G. 2020. Epidemiologia y patrones de sensibilidad a los antimicrobianos de microorganismos aislados de hemocultivos en niños con leucemia aguda. Medicina Infantil 2020; XXVII: 3 - 9.
40. German, G.J., Jamieson, F.B., Gilmour, M., Almohri, H., Bullard, J., Domingo, MC., Fuller, J., Girouard, G., Haldane, D., Hoang, L., Levett, P.N., Longtin, J., Meano, R., Needle, R., Patel, S.N. 2016. Interian recomendations for the reporting of extensively drug resistant and pan-drug resistant isolates of enterobacteriaceae, Pseudomonas aeruginosa, Acinetobacter spp. And stenotrophomonas maltophilia. Canada Communicable Disease Report. 2016;42(4):91-7
41. Gómez-Gamboa Liliana., Núñez-Chacín Daniela., Perozo-Mena A., Bermúdez-González, J y Marín Milagros. Staphylococcus aureus con resistencia múltiple a los antibióticos (MDR) en un Hospital de Maracaibo- Venezuela Multidrug-resistant (MDR) Staphylococcus aureus in a Maracaibo’s hospital, Venezuela. Kasmera. 44(1): 53 – 65
42. González E, Rueda M, Shelburne, Musher, Hamill. Comunidad de las cepas resistentes a la meticilina de Staphylococcus aureus como la causa de infección asociada a centros de salud. Infect Control Hosp. Epidemiol. 2005: 785-91
43. González Lorenzo A. 2003. Resistencia antimicrobiana “in vitro”. Sistema Diramic 10. Un año de experiencia. Rev Méd Electrón [Internet]. [citado 12 Feb 2013];25(6). Disponible en: http://www.revmatanzas.sld.cu/revista%20medica/ano%202003/vol6%202003/tema05.htm
44. González MS, Pérez AG. Proposal of actions to improve accessibility at the Hotel Las Yagrumas, Artemisa. Management (Montevideo) 2024;2:25–25. https://doi.org/10.62486/agma202425.
45. González, M.L., Martínez Magaly., López, N., Montesino Maipú., Pérez, Y e Martínez, H. 2016. Resistencia microbiana de microorganismos aislados en neonatología: Hospital “Abel Santamaría Cuadrado” 2015. Revista de Ciencias médicas de Pinar del Rio. 20 (5)
46. González, M.M.L., López, N.M., Montesino, L.M, Pérez, P.Y y Martínez, S.H. 2016. Resistencia microbiana de microorganismos aislados en neonatología: Hospital. Rev Ciencias Médicas. 20 (5): 593-602.
47. Gonzalez-Argote J, Castillo-González W. Problem-Based Learning (PBL): review of the topic in the context of health education. Seminars in Medical Writing and Education 2024;3:57–57. https://doi.org/10.56294/mw202457.
48. Hernández-Flórez N, Rosa EB de la, Klimenko O, Santander MJO, Araque-Barboza F, Vásquez-Torres J. Cognitive Impairment in the Elderly: A systematic review of the literature. Salud, Ciencia y Tecnología 2024;4:799–799. https://doi.org/10.56294/saludcyt2024799.
49. HiramatsuK., Cui L., Kuroda M.La aparición y evolución del estafilococo meticilino resistente. Tendencias Microbiologicas.2001; 9: 486-93.
50. Hoet AE., Van-Balen J. Staphylococcus aureus resistente a la meticilina (SARM) en el ambiente hospitalario. Rev Soc Ven Microbiol 2011; 33 (1): 48-49.
51. Informe 2012. Resistencia antibiótica. Servicio de Microbiología clínica. Complejo Asistencial Junta de León.
52. İpek MA, Yıldırım AC, Büyükbudak E, Tomás J, Severino S, Sousa L. Physical activity and successful aging: community-based interventions for health promotion. Community and Interculturality in Dialogue 2024;4:.157-.157. https://doi.org/10.56294/cid2024.157.
53. Knols, B. G., Smallegange, R. C., Tacconelli, E., Magrini, N., Kahlmeter, G y Singh, N. 2009. Global Priority List Of Antibiotic-Resistant Bacteria To Guide Research, Discovery, And Development Of New Antibiotics. Lancet Infect. Dis., vol. 9, no. 9, pp. 535–536
54. Koneman. Diagnóstico microbiológico. 2012
55. Kravchenko H, Ryabova Z, Kossova-Silina H, Zamojskyj S, Holovko D. Integration of information technologies into innovative teaching methods: Improving the quality of professional education in the digital age. Data and Metadata 2024;3:431–431. https://doi.org/10.56294/dm2024431.
56. Lona, J.C., Verdugo, M.A., Pérez, R.O., Pérez, J.J y Ascencio, E.P. 2015. Etiología y patrones de resistencia antimicrobiana en sepsis neonatal temprana y tardía, en una Unidad de Terapia Intensiva Neonatal. Arch. Argent. Pediatr. [Online]. Vol.113 (4) [citado 2016-03-16], pp. 317-323. Disponible en: http://www.scielo.org.ar/scielo.php?script=sci_arttext&pid=S0325-00752015000400007&lng=es&nrm=iso
57. Lopardo H, Pasterán, Litterio M, et al. El desafío de la resistencia. Medicina Infantil 2014; 21: 131-47.
58. Lopardo Horacio. La resistencia a vancomicina más allá de los enterococos. Medicina Infantil 2016; XXIII: 303 - 307.
59. López DES, Cruz AE. Clinical experience of a patient with hemopericardium. Multidisciplinar (Montevideo) 2024;2:69–69. https://doi.org/10.62486/agmu202469.
60. Losada MF. The Organizational Culture as a Driver of Business Growth: A Comprehensive Approach. SCT Proceedings in Interdisciplinary Insights and Innovations 2024;2:237–237. https://doi.org/10.56294/piii2024237.
61. Macfaddin JF. Pruebas bioquímicas para la identificación de bacterias de importancia clínica. 3ª. ed. t-1. La Habana: Ciencias Médicas; 2006.p. 344-61.
62. Medina, D.A., Machado, M.E y Machado., J.E. 2015. Resistencia a antibióticos, una crisis global. Rev. Méd. Risaralda. 21 (1): 74
63. Montenegro AN, Bálsamo F, Brusca MI, Zunini G, Jewtuchowicz V. Influence of vegan and vegetarian diet on oral health. AG Salud 2024;2:116–116. https://doi.org/10.62486/agsalud2024116.
64. Moreno Karla Marcela. Carbapenémicos: tipos y mecanismos de resistencia bacterianos. Revista Médica de Costa Rica y Centroamérica. LXX (608) 599 - 605, 2013
65. Morosini, M. Isabel., Cercenadob Emilia., Ardanuyc Carmen y Torresd Carmen. 2012. Detección fenotípica de mecanismos de resistencia en microorganismos grampositivos
66. Nodarse Rafael. Detección de Staphylococcus aureus resistente a meticilina mediante disco de cefoxitina. Revista Cubana de Medicina Militar.2009;38(3‐4)30‐39
67. Ñañez-Silva MV, Lucas-Valdez GR, Larico-Quispe BN, Peñafiel-García Y. Education for Sustainability: A Data-Driven Methodological Proposal for the Strengthening of Environmental Attitudes in University Students and Their Involvement in Policies and Decision-Making. Data and Metadata 2024;3:448–448. https://doi.org/10.56294/dm2024448.
68. Ogolodom MP, Egop EB, Alazigha N, Rufus A, Ezugwu EE, Ikegwuonu NC, et al. Magnetic resonance imaging findings in cervical pathologies and its’ correlation with patient´s body mass index in Anambra state, Nigeria: a cross-sectional study. Multidisciplinar (Montevideo) 2024;2:68–68. https://doi.org/10.62486/agmu202468.
69. Oliva E, Díaz M. Exploration of regularities in bipartite graphs using GEOGEBRA software. LatIA 2024;2:51–51. https://doi.org/10.62486/latia202451.
70. Organización Mundial de la Salud (OMS). 2000. Resistencia a los antimicrobianos: una amenaza mundial. Bol. Medicam. Escenciales, vol. 28–29, pp. 1–36.
71. Organización Mundial de la Salud (OMS). 2017. Centro de prensa. Resistencia a los antibióticos. [Online consultado 26 abril 2021]. Disponible: http://www.who.int/mediacentre/factsheets/antibiotic-resistance/es/.
72. Ortega L. María. 2010. Enterococos: actualización. Revista Habanera de Ciencias Médicas 2010:9(4) 507-515
73. Ortega P, Virgilito A. Zygomatic Implants: The importance of the correct choice of surgical technique. Odontologia (Montevideo) 2024;2:124–124. https://doi.org/10.62486/agodonto2024124.
74. Oteo J. Detección de resistencia a oxacilina en un aislado de Staphylococcus aureus en bacteremia. Casos de Microbiología Clínica. 2004;7(1):10.
75. Oubellouch H, Aziz S. Risk assessment for the liquefied petroleum gas filling industry using fuzzy logic and hazard and operability. Salud, Ciencia y Tecnología 2024;4:749–749. https://doi.org/10.56294/saludcyt2024749.
76. P LR. Innovating in Mental Health: Metacognitive Psychotherapy. Interdisciplinary Rehabilitation / Rehabilitacion Interdisciplinaria 2024;4:74–74. https://doi.org/10.56294/ri202474.
77. Parada REA, Ferrer MF, Astbury M de los Á, Brazza S. Frequency of cases of Argentine Hemorrhagic Fever in the province of Santa Fe between the years 2018 to 2022. AG Salud 2024;2:119–119. https://doi.org/10.62486/agsalud2024119.
78. Parra AL, Escalona E, Navarrete FB. Physical fitness assessment of a Venezuelan industrial direct labor force population. Interdisciplinary Rehabilitation / Rehabilitacion Interdisciplinaria 2024;4:88–88. https://doi.org/10.56294/ri202488.
79. Paz-Montes, A., Fuenmayor, Alisbeth., Sandrea, L., Piña-Reyes, E., López-Dávila, M y Navarro, P. 2015. Incidencia de microorganismos en hemocultivos procesados en un hospital del estado Zulia y su resistencia a los agentes antimicrobianos. Kasmera. 43 (1): 16 – 33
80. Peña-Méndez A, Gutiérrez EI, Hernández IM, Díaz-González Y, Crispin-Castellanos D. Didactic strategy for the training of skills in clinical trials of Stomatology residents. Seminars in Medical Writing and Education 2024;3:59–59. https://doi.org/10.56294/mw202459.
81. Pérez-Cano, H.J y Robles-Contreras, A. 2013. Aspectos básicos de los mecanismos de resistencia bacteriana. Revista Médica MD. Volumen 4 (3): 187-190
82. Prieto A, Rodríguez Y, Fonseca M, García A, González N. 2013. Comportamiento de la bronquiolitis aguda en la Unidad de Cuidados Intensivos Pediátricos de Cienfuegos. Rev Cub Med Int Emerg 12 (4). Disponible en: http://bvs.sld.cu/revistas/mie/vol12_4_14/mie09413.pdf
83. Quiñones Dianelys. 2010. Enterococcus aislados en Cuba: resistencia antimicrobiana, virulencia y diversidad genética. Tesis presentada en opción al grado científico de Doctor en Ciencias Médicas. Instituto de Medicina Tropical. 158 p
84. Razooq AM, Sayhood EK, Resheq AS. Effects of steel reinforcement ratios on the flange effective width for reinforced concrete T-beams casting with recycled coarse aggregate. Salud, Ciencia y Tecnología - Serie de Conferencias 2024;3:820–820. https://doi.org/10.56294/sctconf2024820.
85. Rice LB. 2006. Antimicrobial resistance in gram-positive bacteria. doi: 10.1016/j.ajic.2006.05.220
86. Rincón S, Panesso D, Díaz L, et al. Resistencia a antibióticos de última línea en cocos Gram positivos: la era posterior a la vancomicina. Biomédica 2014; 34: 191–208
87. Rincón Sandra, Panesso Diana, Díaz Lorena, Carvajal Lina P., Reyes Jinnethe, Munita J. M., Arias, C. Resistencia a antibióticos de última línea en cocos Gram positivos: la era posterior a la vancomicina. Biomédica. 2014; 34 (Supl.1): 191-208. doi: http://dx.doi.org/10.7705/biomedica.v34i0.2210
88. Rivas JP. State administrative reparation to the victims within the framework of theJEP in the Municipality of Quibdo in the period 2018-2022. SCT Proceedings in Interdisciplinary Insights and Innovations 2024;2:239–239. https://doi.org/10.56294/piii2024239.
89. Riveros ER, Espinoza MÁL. Relationship between sociodemographic factors and quality of life in hemodialysis patients. Salud, Ciencia y Tecnología 2024;4:744–744. https://doi.org/10.56294/saludcyt2024744.
90. Roberts JA, Roberts MS, Semark A, Udy A, Kirkpatrick C, Paterson D. 2011. Antibioticdosing in the `at risk’ critically ill patient: Linking pathophysiology with pharmacokinetics/pharmacodynamics in sepsis and trauma patients. BMC Anesthesiology. 2011 [citado 12 Oct 2021]; 11(3). Disponible en: http://bmcanesthesiol.biomedcentral.com/articles/10.1186/1471-2253-11-3
91. Rodríguez-Noriega, E, Seas Carlos. Patrón cambiante de los clones de Staphylococcus aureus resistente a meticilina en América Latina. Rev. Chil. Infect 2016; 27: 59-69.
92. Rojas Nidia., Fernández Natacha., Espino María y Fernández María de los Ángeles. Patrones de drogorresistencia de cepas de Staphylococcus aureus de origen clínico humano. Rev Cubana Med Trop. 2001;53 (1):53-8
93. Romaniszyn D, Różańska A, Wójkowska-Mach J, Chmielarczyk A, Pobiega M, Adamski P, et al. Epidemiology, antibiotic consumption and molecular characterization of Staphylococcus aureus infections - data from the Polish Neonatology Surveillance Network, 2009–2012. BMC Infectious Diseases 2015; 15:169-178.
94. Ruiz- Garbajosa Patricia y Cantón, R. 2016. Epidemiología de los bacilos Gran negativos multirresistentes. Rev Esp Quimioter.29 (Suppl. 1): 15-20
95. Rybak MJ. 2006. Pharmacodynamics: Relation to antimicrobial resistance. Am J Infect Control. 34: S38-45.
96. Sánchez-Castillo V, Romero RÁ, Olascoaga BGJ. Analysis of research trends on the implementation of information systems in the agricultural sector. Data and Metadata 2024;3:442–442. https://doi.org/10.56294/dm2024442.
97. Santisteban Yesleisy., Carmona, Y., Pérez, Y., Díaz Lilian., García Sandra y Kobayashi, N. 2014. Infecciones por los géneros Klebsiella y Acinetobacter en hospitales pediátricos cubanos y resistencia antibiótica. Rev cubana Med Trop [revista en la Internet]. Dic [citado 2015 jun 17]; 66(3): 400-414. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0375-07602014000300008&lng=es
98. Savitha D, Sudha L. Sentence level Classification through machine learning with effective feature extraction using deep learning. Salud, Ciencia y Tecnología - Serie de Conferencias 2024;3:702–702. https://doi.org/10.56294/sctconf2024702.
99. Sidiq M, Chahal A, Gupta S, Vajrala KR. Advancement, utilization, and future outlook of Artificial Intelligence for physiotherapy clinical trials in India: An overview. Interdisciplinary Rehabilitation / Rehabilitacion Interdisciplinaria 2024;4:73–73. https://doi.org/10.56294/ri202473.
100. Skov R, Lov M. Evaluation of a cefoxitin 30 ìg disc on Iso-Sensitest agar for detection of MRSA. J Antimicrob Chemother. 2003; 52: 204-7.
101. Tarai B, Das P, Kumar D. Recurrent Challenges for Clinicians: Emergence of Methicillin‑resistant Staphylococcus aureus, vancomycin resistance, and current treatment options. J Lab Physicians 2013; 5 (2): 71-78.
102. Tarai B, Das P, Kumar D. Recurrent Challenges for Clinicians: Emergence of Methicillin‑resistant Staphylococcus aureus, vancomycin resistance, and current treatment options. J Lab Physicians 2013; 5 (2): 71-78
103. Torres Nancy., Velásquez, R., Mercado, E., Egoavil Martha., Horna Gertrudis., Mejía Lida., Castillo María., Chaparro, E., Hernández, R., Silva Wilda., Campos, F., Sáenz, A., Hidalgo, F., Letona Carolina., Valencia, Á., Cerpa Rosario., López-de-Romaña, B., Torres Berenice., Castillo Fiorella., Calle Andrea., Rabanal Synthia., Pando Jackeline., Lacroix Elizabeth., Reyes Isabel., Guerra, H y Ochoa Theresa. Resistencia antibiótica de Streptococcus pneumoniae en portadores nasofaríngeos sanos de siete regiones del Perú. Rev Peru Med Exp Salud Publica. 2013; 30 (4): 575-82.
104. Virú Yamilet. 2019. Caracterización microbiológica de bacterias aisladas de catéter venoso de pacientes hospitalizados en el Hospital Nacional Docente Madre Niño San Bartolomé de noviembre del 2017 a diciembre del 2018. Tesis en opción al Título Profesional de Licenciada en Tecnología Médica en el área de Laboratorio Clínico y Anatomía Patológica. Universidad Nacional Mayor de San Marcos. 83 p
105. Volodymyr V, Kolumbet V, Halachev P, Khambir V, Ivanenko R. Methods and algorithms of optimization in computer engineering: review and comparative analysis. Data and Metadata 2024;3:443–443. https://doi.org/10.56294/dm2024443.
106. Wagenvoort JHT. Medidas de control de SARM adoptadas por los Países Bajos, a raíz de la expansión de la Unión Europea. Euro Surveil. 2000;5(3):26-8.
107. Wilson M, Otth C, Medina G, Otth L, Fernández H, Arce M, Zaror A, et al. Genotipos de Staphylococcus aureus con fenotipo meticilino resistente, aislados de pacientes del Hospital Base de Valdivia. Rev Méd Chile 2007; 135: 596- 601
108. Worley H. 2003. La resistencia a los antimicrobianos pone en riesgo el avance médico. Population reference bureau [citado 15 Feb 2013]. Disponible en: http://www.prb.org/SpanishContent/Articles/2006/LaResistenciaalosAntimicrobianosPoneenRiesgoelAvanceMedico.aspx
109. Zapata RE, Guerrero EC, Montilla RE. Emerging Technologies in Education: A Bibliometric Analysis of Artificial Intelligence and its Applications in Health Sciences. Seminars in Medical Writing and Education 2024;3:49–49. https://doi.org/10.56294/mw202449.
110. Zapata RJ. Gentrified Humanities? An analysis of the main trends in the Scopus database. Gentrification 2024;2:53–53. https://doi.org/10.62486/gen202453.
FINANCIACIÓN
Los autores no recibieron financiación para el desarrollo de la presente investigación.
CONFLICTO DE INTERÉS
Ninguno.
CONTRIBUCIÓN DE AUTORÍA
Conceptualización: Noel Suarez Reyes, Miguel Luis González Martínez, Kirenia Apaulaza Corrales, Diana Lobo Riverol, Leidy Liana López Ramos.
Investigación: Noel Suarez Reyes, Miguel Luis González Martínez, Kirenia Apaulaza Corrales, Diana Lobo Riverol, Leidy Liana López Ramos.
Supervisión: Noel Suarez Reyes, Miguel Luis González Martínez, Kirenia Apaulaza Corrales, Diana Lobo Riverol, Leidy Liana López Ramos.
Redacción – borrador original: Noel Suarez Reyes, Miguel Luis González Martínez, Kirenia Apaulaza Corrales, Diana Lobo Riverol, Leidy Liana López Ramos.
Redacción – revisión y edición: Noel Suarez Reyes, Miguel Luis González Martínez, Kirenia Apaulaza Corrales, Diana Lobo Riverol, Leidy Liana López Ramos.