doi: 10.56294/hl2024.514
ORIGINAL
Comparison of healing activity between azadirachta indica and moringa oleifera seed oils on cutaneous wounds in wistar rats
Comparación de actividad cicatrizante entre los aceites de las semillas de azadirachta indica y moringa oleífera en heridas cutáneas en ratas wistar
Alexandra López Barrera1
![]() *, Zoraida Burbano Gómez1
*, Zoraida Burbano Gómez1
![]() *, Carlos Jefferson Valdiviezo Rogel1
*, Carlos Jefferson Valdiviezo Rogel1
![]() *, Glenda Marcela
Sarmiento Tomalá1
*, Glenda Marcela
Sarmiento Tomalá1 ![]() *, Francisca Patricia Jimenez Granizo1
*, Francisca Patricia Jimenez Granizo1
![]() *, Pilar Asunción
Soledispa Cañarte1
*, Pilar Asunción
Soledispa Cañarte1 ![]() *
*
1Universidad de Guayaquil, Facultad de Ciencias Químicas. Guayaquil, Ecuador.
Citar como: López Barrera A, Burbano Gómez Z, Valdiviezo Rogel CJ, Sarmiento Tomalá GM, Jimenez Granizo FP, Soledispa Cañarte PA. Comparison of healing activity between azadirachta indica and moringa oleifera seed oils on cutaneous wounds in wistar rats. Health Leadership and Quality of Life. 2024; 3:.514. https://doi.org/10.56294/hl2024.514
Enviado: 03-04-2024 Revisado: 03-08-2024 Aceptado: 02-12-2024 Publicado: 03-12-2024
Editor:
PhD. Prof. Neela Satheesh
![]()
Autor para la correspondencia: Alexandra López Barrera *
ABSTRACT
Medicinal plants are natural remedies that bring benefits to the organism. Phytomedicine’s production has increased in the last decades due to the adverse reactions of designer drugs. This research focused on basic principles that rule the scarification of wounds as a natural response to the damages produced with specific functions of tissue restoration and integrity. For this reason the acceleration of the scarring effect with Azadirachta indica seeds oil and Moringa was studied. Nine groups of animals were made: normal, negative and negative control, three Neem groups, three Moringa groups (30, 60,120 µl) respectively. The wound was made after placing the animal under anesthesia using the punch method. For seven days, these groups were observed while they received the treatment. After the test, the animals were euthanized, and scarred skin tissue samples were collected for histopathologic tests. As a result, after the second day, the concentration of Neem tested 4,38 mg/ml showed humity and inflammation of 73 % and 76 % respectively, which eventually dropped to zero. The presence of crust in the third day was 20 % and in the sixth, 100 %. On the other hand, concerning to the Moringa oil 4,48 mg/ml, no significant changes could be seen in any of the evaluated parameters. Comparing the percentages of the crust coverage among these groups, it can be said that: natural scarification
(B) 10 % the third day and 40 % at the end of the research. The subjects treated with neem (E) 30 % the third day and 100 % the sixth, while D, F 80 % the same day and 100 % the seventh, the same as seen in C (iodine). The groups with Moringa presented 10 % in the third day and 60 % by the end. In conclusion, the groups with neem showed acceleration in the scarification process within the experimentation period.
Keywords: Cicatrization; Concentration; Neem; Moringa; Mechanism of Action.
RESUMEN
Las plantas medicinales son remedios naturales que aportan beneficios al organismo. La fitomedicina se ve incrementada en las últimas décadas, debido a que las drogas de síntesis producen reacciones adversas. Esta investigación fue enfocada en principios básicos que rigen la cicatrización de heridas como respuesta natural a los daños producidos con funciones específicas de restauración e integridad tisular. Por esto se evaluó la aceleración del efecto cicatrizante entre el aceite de las semillas de Azadirachta indica y de Moringa oleífera. Se conformaron nueve grupos de seis animales cada uno: control normal, negativo, positivo, tres grupos Neem, tres grupos Moringa (30, 60,120 µl) respectivamente. La herida fue realizada previa anestesia del animal utilizando el método punch. Se observó y aplicó por siete días los tratamientos a los grupos
respectivos. Finalizada la prueba los animales recibieron eutanasia y se recogió muestra de piel cicatrizada para ensayos histopatológicos. Como resultado se obtuvo que la concentración de Neem ensayada 4,38 mg/ml presentó a partir del segundo día humedad e inflamación 73 y 76 % respectivamente; que disminuyeron paulatinamente hasta un cero %. La presencia de costra, en el día tres fue 20 y en el seis 100 %. Por otro lado el aceite de Moringa 4,48 mg/ml no se observó cambios significativos en ninguno de los parámetros evaluados. Comparando los porcentajes de presencia de costra entre los grupos tenemos; cicatrización natural (B) el tercer día un 10 y 40 al final del estudio. Los tratados con Neem (E) el tercer día 30 y el en sexto el 100, mientras D, F un 80 y el séptimo día el 100, igual resultado presentó C (yodo). Los grupos con Moringa en el tercer día presentaron 10 y al término 60. Se concluye que los grupos con Neem presentaron aceleración en el proceso de cicatrización dentro del periodo de experimentación.
Palabras clave: Cicatrización; Concentración; Neem; Moringa; Mecanismo de Acción.
INTRODUCCIÓN
La piel es la primera barrera protectora frente a agresiones externas y la primera línea de defensa contra agentes infecciosos, actúa como órgano sensitivo a través de una extensa red de neuronas y terminales nerviosas, recoge información tales como: presión, vibración, dolor, temperatura.(1,2,3) Cuando los peligros externos se detectan a tiempo pueden emprenderse acciones para evitarlos y minimizar la lesión, pero el riesgo de lesión aumenta cuando la sensibilidad se pierde.(4,5,6,7)
Así tenemos, la diabetes mellitus es una enfermedad crónica no transmisible, de alta prevalencia a nivel mundial. Una de las graves consecuencias de esta patología; es el síndrome de pie diabético que es una complicación asociada, la cual puede llevar al desarrollo de heridas y úlceras, con la consiguiente posibilidad de infección.(8,9,10,11) Siendo este un problema de salud mundial que registran un creciente número de afectados es que se considera esta problemática dentro de este estudio por las consecuencias que acarrea esta enfermedad.(12,13,14) Tal como se describe brevemente a continuación el índice de las personas afectadas por este mal.(15,16,17,18)
En la última década, el porcentaje de muertes atribuibles a la diabetes en menores de 70 años es superior en los países de ingresos bajos y medianos que en los de ingresos altos.(19)
En tanto que, en Latinoamérica el número de diabéticos tipo 2 en el año 2000 fue de 35 millones, y esta cifra subirá a 64 millones en el año 2025.(20) En el Ecuador, la diabetes se ha convertido en la principal causa de defunciones de acuerdo a datos del Instituto Nacional de Estadísticas y Censos (INEC) en el año 2006, ocupa el tercer puesto en un 5,1 %, en el año 2007 y 2008, ocupa el primer puesto con un 5,7 %, en el 2009 ocupó el primer lugar con un 6,8 % y en el 2010 con un 6,5 % ocupó el segundo lugar de causa de muerte de la población.(21,22,23)
Una de las grandes preocupaciones en los procesos quirúrgicos es la cicatrización de las heridas, que puede ser patológica (hipertrófica o queloide) o dar lugar a un resultado cicatricial defectuoso, puesto que en muchas ocasiones se ven afectadas por la ocurrencia de sepsis lo que conlleva a abrirla total o parcialmente para controlar la supuración y que el proceso de curación evolucione normalmente.(24,25,26)
En el cuidado perioperatorio, la apertura espontánea de una herida sigue siendo una de las complicaciones más serias a la que los cirujanos enfrentan en ciertas ocasiones de su práctica quirúrgica, con una frecuencia que va entre 0 a 6 % y hasta 10 % en otras con una mortalidad de 9 al 44 %.(27,28)
El uso de Azadirachta indica, como planta medicinal constituye una buena alternativa en la actualidad; conocida por sus diversas propiedades medicinales que se encuentran en su hojas, savia, fruto, semillas y vástagos.(29,30,31)
Por otro lado, existen otras actividades que han sido comprobadas en las semillas tales como: efectos analgésicos, diuréticos, antipiréticos, vermífugos, antisépticos, antisifilíticos, astringentes, emolientes, y purgantes así mismo se ha demostrado que los extractos poseen propiedades antibacterianas, antidiabética, antifúngica, antiviral.(32,33,34)
La Moringa oleífera, presenta actividades específicas en sus diferentes partes tales como las raíces, hojas, flores, frutas y semillas contienen: alcaloides, flavonoides, carotenoides, taninos, antraquinonas, antocianinas y proantocianidinas, debido a la presencia de estos compuestos fitoquímicos son las diferentes acciones farmacológicas, que presenta la Moringa.(35,36,37)
Las acciones farmacológicas tales como: anticáncer; antioxidante; antiinflamatorio en artritis, artrosis, el reumatismo; inmunomodulador; antidiabético; y hepatoprotectora es utilizado también hipercolesterolemia, hipertensión, diabetes, padecimientos neurodegenerativos, anemia, problemas de fertilidad, padecimientos hepáticos y renales, desórdenes de la piel y comosuplemento alimenticio en mujeres embarazadas, niños.(38,39,40)
Las semillas de Moringa oleífera actúan como antimicrobianas, antihongos, anti bacterial, son eficaces contra las bacterias que infectan la piel de Staphilococcus aureus y Pseudomonas aeruginosa porque contienen potentes antibióticos y fungicidas.(41,42,43)
Además, por sus propiedades humectantes y nutritivas debido al alto contenido en ácido oleico y tocoferoles el aceite de Moringa está siendo muy utilizado en la industria cosmética en la que se han desarrollado productos, como jabón de manos, aceite de belleza, loción corporal y exfoliante corporal.(44,45,46)
El aceite de Ben es producido por las semillas maduras las cuales comprenden entre un 38,40 % del aceite comestible, el cual contiene una alta concentración en ácido behénico. El aceite de Moringa no entra en un estado de rancidez debido a su gran contenido de ácido oleico, por ello puedo durar varios años posteriores a su producción por lo tanto la oxidación no se produce.(47,48,49)
El presente estudio tiene como objetivo evaluar cuál de los dos aceites obtenidos posee mayor actividad cicatrizante debido a que no existen antecedentes comparativos entre ellos ni muchos menos con esta actividad. En principio es contribuir una nueva adquisición para el tratamiento de cicatrización de heridas por los múltiples factores que afectan a la misma o por los grandes índices de porcentajes que existen sobre las causas que lo producen ya sea por diabetes o por algún tipo de cirugía las cuales son las más comunes.
Objetivo general
Evaluar el efecto cicatrizante entre el aceite de las semillas de Azadirachta indica y el aceite de las semillas de Moringa oleífera, aplicadas en heridas producidas en piel de los animales de experimentación.
MÉTODO
Diseño experimental de la investigación
Para realizar esta investigación se llevó a cabo los siguientes procesos:
1. Recolección de la muestra vegetal Neem: para la cosecha de las semillas de Azadirachta indica se procedió a la obtención de las mismas a partir de los árboles ubicados vía a la Costa km 71,5 en el mes de Marzo del presente año, para su recolección, los frutos maduros fueron recogidos en fundas plásticas, se tomó aquellas semillas que no se presentaban alteración en su textura.
2. Clasificación botánica: almacenadas las semillas de Azadirachta indica se procedió a colocarlas en una tabla forrada con papel bond para enviar las hojas y las semillas para la identificación de la especie, al herbario Guay de la Facultad de Ciencias Naturales de la Universidad de Guayaquil (anexo 5).
3. Obtención del aceite de la semilla de Neem: esta fase se realizó en el Laboratorio de Productos Naturales para Investigación Docente y Estudiantil de la Facultad de Ciencias Químicas, para lo cual se realizaron las siguientes etapas:
1) Secado de la semilla: las semillas fueron secadas naturalmente, para ello se colocó diariamente en un papel bond expuestas al sol por un periodo de tiempo no menor a 30 días, asegurando que dentro de este proceso se extraiga toda la humedad presente en las semillas, por lo que se las cambio de posición cada cierto tiempo.
2) Reducción a polvo fino: desecadas las semillas se procedió a triturarlas en un molino para la obtención de polvo fino para que facilite las extracciones.
3) Extracción del aceite: a partir de las semillas desecadas y trituradas se obtuvo el aceite de la semilla por el método de SOXHLET para ello se siguió los siguientes pasos:
a) Se fabricó el dedal, (receptáculo de la muestra en el equipo), con papel filtro de diámetro 2,5 cm alto 12,5 cm.
b) Se tomó y se registró el peso a cada dedal.
c) Se pesó en la balanza analítica, (BOECO GERMANY), de muestra entre 40 y 60 g aproximadamente
d) La muestra contenida en el dedal, se la coloco en el sifón.
e) Se colocó 500 ml aproximadamente del solvente hexano en el balón pírex de 1000 ml.
f) Utilizando un calentador THERMOLYNE a una temperatura de 69ºC durante 3 horas.
g) Se realizó entre 5 a 6 sifonadas por muestra.
h) Luego para asegurar que el aceite se encuentra libre de hexano, se utilizó el rotaevaporador HEIDOLPH a (35-40ºC) con ayuda de una bomba de vacío HEIDOLPH para recuperar el solvente el mismo que sirvió para nuevas extracciones.
i) Posterior a esto se colocó el aceite obtenido en un frasco ámbar para su almacenamiento en refrigeración para evitar contaminación alguna (anexo 6).
Control de calidad del aceite de la semilla de Azadirachta indica
Los parámetros fisicoquímicos que se realizaron al aceite de Neem se lo llevo a cabo en el Laboratorio PROGECA (Programa de Gestión de la Calidad) de la Facultad de Ciencias Químicas, siguiendo los procedimientos que se encuentra descritos en las normas INEN que definan la calidad de un aceite según se detalla a continuación: (anexo 7)
Características organolépticas del aceite
Determinación del olor: con una tira de papel secante de aproximadamente 1 cm de ancho por 10 cm de largo, se introducirá en un extremo de la muestra. Se percibe y se determina si corresponde con las características del producto.
Determinación del color: Se toma una probeta de 10 ml (tipo B) de vidrio transparente bien limpia y seca, se llena hasta las tres cuartas partes con la muestra y se observa el color que presenta y si hay presencia o no de partículas extrañas.
Constantes físicas
Densidad relativa: se siguió el método descrito en la Norma INEN 0035 GRASAS Y ACEITES COMESTIBLES. DETERMINACIÓN DE LA DENSIDAD RELATIVA.
· Lavar y secar cuidadosamente el picnómetro y pesarlo en la balanza analítica (KERN ABS), registrar el resultado como M.
· Llenar completamente el picnómetro (limpio y seco) con agua destilada y taparlo cuidadosamente evitando la inclusión de burbujas de aire, procurando mantener la temperatura 25º C (± 1ºC) durante 15 min.
· pesar el picnómetro en la balanza analítica (KERN ABS) y registrar el resultado como M1.
· Llenar completamente el picnómetro( limpio y seco) con la muestra hasta el foro.
· Taparlo cuidadosamente evitando la inclusión de burbujas de aire.
· Pesar en la balanza analítica (KERN ABS) el picnómetro con la muestra, el resultado registrarlo como M2.
· La densidad relativa a 25ªC se calcula mediante la siguiente ecuación:
𝑀2−𝑀
D25 = 𝑀1−𝑀
Dónde:
D25= densidad relativa a 25/25°C.
M1= peso del picnómetro con agua destilada (g). M2= peso del picnómetro con la muestra (g).
M = peso del picnómetro vacío (g).
Determinación de pH
Se calibró el potenciómetro (OAKTON) con la solución reguladora de pH adecuada al rango en que se realizó la determinación. Posteriormente se determinó el valor del pH del aceite de Neem.
Índice de refracción
Se siguió el método descrito en la Norma INEN 0042 GRASAS Y ACEITES COMESTIBLES. DETERMINACIÓN DEL ÍNDICE DE REFRACCIÓN.
· Se filtró la muestra para eliminar impurezas.
· Se ajustó la temperatura a 25 o 40 °c.
· Se limpió el prisma del refractómetro (thermo electron corporation) con agua destilada y con una tira de papel filtro hasta que se seque por completo.
· Se calibró en 1,3 y se colocaron dos gotas del aceite de neem (llevada aproximadamente a 25 o 40 °c) sobre el prisma inferior.
· Se dejó en reposo durante unos minutos para que la muestra adquiera la temperatura del instrumento.
· Se ajustó el instrumento y la luz para obtener la lectura más clara posible.
· Se determinó el índice de refracción.
· Este análisis se realizó por duplicado.
Índice de acidez
Se siguió el método descrito en la Norma INEN 0038 GRASAS Y ACEITES COMESTIBLES. DETERMINACIÓN DE ACIDEZ.
La determinación se realizó por duplicado sobre la misma muestra preparada.
· Pesar sobre una fiola de 200 ml una cantidad de muestra comprendida entre 5,000 g y 10,000 g ± 0,5000 g si el aceite es crudo, o entre 20,000 g y 25,000 g ± 0,5000 g si el producto es refinado.
· Se adiciona 50 ml de alcohol neutro, calentar el aceite por 1 o 2 minutos hasta que el aceite se haga miscible en alcohol, agregar 1 a 3 gotas de fenolftaleína y se llena la bureta (tipo A) con solución estándar de hidróxido de sodio 0,1N para aceite crudos y 0,01N para aceites refinados para titular.
· Se anota el consumo de hidróxido de sodio, cuando el indicador permanece por 30 segundos rosado, siendo este el punto final de la valoración.
Índice de peróxido
Se siguió el método descrito en la norma INEN 00277 GRASAS Y ACEITES COMESTIBLES. DETERMINACIÓN DE ÍNDICE DE PERÓXIDO.
La determinación se realizó por duplicado sobre la misma muestra preparada y en Sorbona.
· Pesar 5,000 g ± 0,5000 g de grasa o aceite en un Erlenmeyer de 200 ml con boca y tapa esmerilada.
· Se adiciona 30 ml de solución acético-cloroformo (3:2). Se agita hasta que se disuelva la muestra.
· Se adiciona 0,5 ml de solución saturada de yoduro de potasio. Se dejar la solución en reposo, agitando de vez en cuando durante 1 minuto.
· Adicionar inmediatamente 30 ml de agua destilada. Agregar 0,5 ml de solución indicadora de almidón.
· Se llena la bureta (tipo A) con tiosulfato sódico 0,01N y se valora gradualmente, hasta desaparición del color negruzco, o sea incoloro con ayuda del agitador magnético CORNING.
Índice de yodo
Se siguió el método descrito en la norma INEN 0037 GRASAS Y ACEITES COMESTIBLES. DETERMINACIÓN DE ÍNDICE DE YODO.
La determinación se realiza por duplicado sobre la misma muestra preparada.
· Pesar 1,000 g ± 0,5000 g de grasa o aceite en un matraz de 500 ml.
· Se adiciona 10 ml de cloroformo, se agita por un momento.
· Se adiciona 25 ml del reactivo de Wijs, se agita por un momento y se tapa el matraz.
· Se guarda el matraz en un lugar oscuro durante 30 minutos a una temperatura comprendida entre 20°C y 30°C.
· Se añade 10 ml de solución yoduro de potasio 15 % y luego 50 ml de agua destilada recién hervida y enfriada.
· Se llena la bureta (tipo A) 50 ml con tiosulfato 0,1 N y se procede a valorar.
Índice de saponificación
Se siguió el método descrito en la Norma INEN 0040: GRASAS Y ACEITES COMESTIBLES. DETERMINACIÓN DEL ÍNDICE DE SAPONIFICACIÓN.
La determinación se realizó por duplicado sobre la misma muestra preparada.
· Pesar 1,000 g ± 0,5000 g de grasa o aceite en un matraz de 500 ml
· Se adiciona por medio de una pipeta volumétrica, 50 ml de una solución alcohólica de 0,5 N de KOH, cerrar el matraz con un tapón de caucho perforado que lleva un tubo recto de algunos pies de longitud o con un refrigerante de extremo esmerilado, que ajuste perfectamente a la fiola.
· Hervir suavemente sobre un baño maría por 30 minutos o hasta que la muestra esté totalmente saponificada, lo cual puede determinarse al observar que la solución es homogénea, o cuando al interrumpir la ebullición no se detecten glóbulos de aceite.
· Cuando la saponificación ha concluido, se deja enfriar el matraz, se añade 1 ml de solución de indicador de fenolftaleína y se titula el exceso de álcali con solución 0,5 N de H Cl. Simultáneamente proceder a realizar una determinación en blanco.
Pérdida por secado
Se siguió el método descrito en la Norma USP 29.
· La determinación se realiza por duplicado sobre la misma muestra preparada
· Sobre el cristalizador previamente tarado, pesar 2,000 g ± 0,5000 g de grasa o aceite.
· Colocar el cristalizador, junto con su contenido, durante 4 horas en la estufa calentada a 105 ° ± 2 ° C. A continuación, enfriarlos hasta temperatura ambiente y pesarlos
Determinación del perfil lipídico de ácidos grasos y omegas presentes en el aceite de Neem
Para la realización de estos parámetros se procedió a enviar en un frasco ámbar una cantidad de 250 ml de muestra (aceite de Neem) previamente rotulado a Laboratorios UBA para su respectivo análisis. Para esto, se siguió el método de Extracción de Grasas totales: Folch Modificado 1957.Preparación de esteres metílicos de ácidos grasos (FAME’s): Ackman 1969, Transesterificación. Se siguió los siguientes pasos para el tratamiento de la muestra:
1. Se pesó una cantidad determinada de muestra previamente tratada para el proceso de extracción de grasas totales.
2. Las grasas obtenidas son transesterificadas hasta obtención de los respectivos FAME’s. Este proceso incluye:
a. Saponificación de las grasas con la solución de Hidróxido de sodio en metanol.
b. Transesterificación de los ácidos grasos libres en solución de trifluoruro de boro en metanol.
3. Los FAME’s obtenidos a partir de la muestra fueron analizados mediante Cromatografía de Gases con detección de ionización de llama (GC-FID).
4. La cuali-cuantificación de los FAME’s presentes se realizó por comparación con un estándar de FAME’s de origen animal y/o vegetal (K4000 FAME Mix; L209 FAME Mix) (anexo 8).
Determinación del perfil lipídico de ácidos grasos y omegas presentes en el aceite de Moringa
La recolección, adquisición, tratamiento, clasificación botánica, la obtención del aceite así como los controles de calidad y el perfil lipídico de la Moringa oleífera son datos obtenidos por medio de los tesistas Kevin Zambrano y Jefferson Fabara con el tema” Evaluación de la actividad antiinflamatoria del aceite de Moringa oleífera en ratones de laboratorio de su trabajo de titulación 2016 (anexo 9).
Diseño experimental de las ratas
Se determinó el estudio farmacológico por la vía dérmica, mediante los procedimientos en el que se emplea como modelo biológico las heridas que se practican en las ratas Wistar, así como las observaciones clínicas realizadas durante el tiempo que dura el tratamiento.
Animales
Para el ensayo, se usaron ratas macho de 8 a 10 semanas de edad, con pesos iniciales promedios de: 300 gramos ± 20 provenientes de las instalaciones del Bioterio de la Facultad de Ciencias Químicas.
Durante 7 días previos al inicio de estudio, el total de animales machos seleccionados (n=54), fueron distribuidos al azar en diferentes jaulas, con el fin de climatizarlos a las nuevas condiciones de mantenimiento y observar posibles alteraciones en su comportamiento. Los animales que no cumplían con las condiciones fueron reemplazados.
Un total de 54 animales, se distribuyeron en 9 grupos de 6 animales por tratamiento.
Con la finalidad, de ejercer un mejor control durante las observaciones y toma de parámetros, a cada animal se los identificó con marcas en el rabo asignándoles un número único.
Tratamientos
En el ensayo, se confeccionaron 9 grupos, que se encuentran registrados en la tabla 1.

Figura 1. Grupos ensayados
|
Tabla 1. Aceite moringa |
|
|
Tratamiento: aceite moringa. |
Herida inducida + aceite moringa en un volumen de 120 µl con una concentración de 2,24 mg/ml |
Bioensayo
La prueba fue realizada, en el área de experimentación (Bioterio) provista de aire acondicionado. Las condiciones de humedad y temperatura ambiental en el periodo de experimentación determinaron valores: temperatura = 23 ± 2 °C; humedad = 30 -70 %. El fotoperiodo provisto durante el ensayo, corresponderá a una relación 10:14 (luz: oscuridad) (anexo 10).
Previo al inicio de la experimentación, los animales seleccionados para el estudio, fueron restringidos en su alimentación la tarde anterior al experimento.
El tiempo de duración de la prueba fue de 9 días (2 de preparación del animal y 7 de aplicación y medición diaria de la herida).
Durante el período de experimentación, los animales estaban mantenidos en cajas individuales, con malla metálica en el piso para evitar que se lastimen las heridas o el contacto con el material que servirá de cama viruta, el mismo que fue cambiado diariamente, cada jaula contenía bebedero y comedero.
Las jaulas descritas fueron identificadas con tarjetas que contenían la siguiente información: grupo de tratamiento al que pertenecen, prueba a realizar, sexo, número del animal, fecha de inicio, y fecha de finalización de la prueba.
A todas las ratas se les realizó una herida en la región dorso escapular de la forma siguiente. Los animales fueron depilados un área no menor del 10 %, (torso), de la superficie corporal utilizando para ello primero una tijera curva para eliminar la mayor cantidad de pelo posible de la zona y luego la ayuda de una depiladora.
Para proceder a efectuar las heridas, atendiendo a los principios éticos del trabajo con animales de experimentación 3Rs (refinamiento), se procedió a anestesiar los animales con Ketamina (50mg/Kg) para ello se utilizó la vía de administración intraperitoneal. Posteriormente a la zona depilada de las ratas se desinfectó con una solución de etanol al 20 %.
Se realizó un punch, con la ayuda de un sacabocado de 10 mm de diámetro, eliminándose el tejido subcutáneo, se trabajó en las condiciones más asépticas posibles.
Para la aplicación, de los aceites (Neem y Moringa) en el estudio, se lo colocó por vía dérmica durante 7 días, los mismos que fueron medidos con micropipeta (BOECO).
El grupo A (normal) con inducción de la herida y aplicación de aceite simple como vehículo, el grupo B tiene la inducción de la herida pero no se aplica ningún tratamiento (para ver la cicatrización natural), el grupo C, (control positivo) se le colocó yodo ( medicamento de actividad comprobada utilizado como antiséptico en heridas de piel),D,E,F se les colocó el aceite de Neem en volúmenes de 30,60,120 µl respectivamente, los grupo G,H,I se utilizó aceite de Moringa en igual volumen que los grupos tratados con el aceite de Neem.
El sacrificio se llevó a cabo el séptimo día de haber empezado la experiencia.
Los animales fueron sacrificados al séptimo día en una cámara saturada de éter, cumpliendo con la aplicación de principios éticos de 3RS (Reducción, refinamiento, reemplazo) con el fin de evitar el dolor y el sufrimiento de los mismos.
Histopatología
Para realizar este estudio, una vez comprobada la muerte en el animal se procedió a realizar un corte a nivel de la cicatriz para obtener la muestra. Para la conservación se la coloco en formol 10 % en solución salina por 48 horas. Se eliminó el exceso de piel (macroscopía).
Luego las muestras son tratadas con formol al 10 % para que se conserven y empezar con el procedimiento histopatológico:
1. Se colocó cada una de las muestras en cassettes de Biopsia por una hora en formol.
2. Luego se las enjuagó con abundante agua tratando de eliminar la mayor cantidad de formol.
3. A continuación, se procedió a secar con gasa los cassette para eliminar la mayor cantidad de agua.
4. Posteriormente se las ubicó durante una hora en Alcohol potable con el fin de reemplazar el agua por alcohol y además para evitar que se deshidraten los tejidos
5. Se realizó dos enjuagues más con alcohol para eliminar cualquier residuo biológico.
6. Luego los cassette fueron colocados en tres envases que contenían xilol, se las mantuvo por espacio de una hora en cada recipiente.
7. Los cassette fueron secados con gasa y luego fueron colocados en parafina dentro de la incubadora (FANEM) por 20 min a temperatura de 60ºC parafina se filtre en el tejido.
8. Luego se los pasó a la parte derecha del dispensador de parafina (LEICA) para dar comienzo al proceso de inclusión por 20 min a 65 ºC. Es decir las muestras han sido embebidas con parafina.
9. A continuación se realizó la formación de bloques: se desecha la tapa del cassette y se introduce muestra del tejido dentro de un molde metálico, teniendo en cuenta de que el tejido esté orientado en posición lateral, ayudado con las pinzas se coloca el cassette , se agrega sobre ella parafina liquida con la ayuda del dispensador, se deja reposar en frío para que se solidifique la parafina.
10. Se realizó cortes del tejido en el micrótomo semiautomático (TBS SHUR CUT 2500), de la muestra en forma de lámina o cintas de parafina de 0,3 micras; la obtención de estas láminas se las hizo a partir de varios cortes del fragmento (1 a 3).
11. Las láminas extendidas fueron colocadas en un baño de flotación de tejidos a 50º C. (LEICA). La muestra con el mejor corte fue seleccionada y con la ayuda de un portaobjeto se recoge el fragmento, se rotula, se coloca en un soporte para placas; este procedimiento se lo realiza para todas las muestras.
12. Las placas con el soporte son llevadas nuevamente a la incubadora por 40 min con la finalidad de eliminar la mayor cantidad de parafina presente, se las retiró y luego de unos minutos se las colocó en xilol por 15 min con el fin de retirar la parafina excedente.
13. Las placas con el soporte fueron colocadas en tres envases de alcohol, se enjuagó en agua y fueron sumergidas en hematoxilina por 3 min para teñir de morado el núcleo. Se enjuagó con agua para eliminar excesos (hematoxilina) y rápidamente se humedece en alcohol, se sumerge en eosina por 2 min. Y finalmente, se pasa nuevamente por alcohol para deshidratar los tejidos para que se pueda realizar el montaje.
14. Para realizar el montaje de las placas se las colocó en xilol por 10 min aprox, se escurre la placa y se agrega entellan (pegamento no soluble en agua) Se les coloca el cubreobjetos evitando la formación de burbujas, se deja escurrir y secar por 1 día aprox. Para realizar la respectiva lectura al microscopio.
RESULTADOS
Evaluaciones clínicas realizadas diariamente a los animales
Se registró la evaluación diaria de los signos clínicos: para cada tratamiento durante el tiempo que duro la valoración, se consideró el % de la humedad presente, la inflamación y la presencia o no de costra.
Resultados Control de Calidad
Los resultados nos permiten demostrar que los aceites que serán objeto de nuestro estudio tienen efecto acelerador de la cicatrización, y que presentan diferencia del resto de grupos, tal como lo revelarán los valores obtenidos.
|
Tabla 2. Densidad relativa |
|
|
Promedio |
0,878 g/ml |
|
Desv. Estándar |
0,0014 |
|
CV |
0,16 % |
Realizó un estudio en el que la densidad obtenida para el aceite de Neem fue semejante a la que se encontró en el presente estudio 0,87 g/ml ± 0,0014, siendo menos denso que el agua, característico de todos los aceites vegetales.
|
Tabla 3. Determinación de pH |
|
|
Promedio |
6,94 |
|
Desv. Estándar |
0,028 |
|
CV |
0,4076 % |
Debido a que se iba a trabajar en heridas de piel era importante considerar el pH; debido que a un pH muy ácido o muy básico podría resultar ser irritante o corrosivo. El pH que se encontró para el aceite de Neem fue de 6,94 lo que permite explicar que los animales que fueron expuestos al aceite de Neem no presentaban ningún tipo de irritación durante los días que duró la prueba.
|
Tabla 4. Índice de peróxidos |
|
|
Promedio |
1,993 meq O2/Kg muestra |
|
Desv. Estándar |
0,0007 |
|
CV |
0,035 % |
Dentro de estos datos se puede observar que existen diferencia entre los valores obtenidos 1,993 ± 0,0007, en tanto que un estudio realizado por un estudio en la que el método utilizado para la extracción del aceite fue el de sohxlet/ hexano dio como resultado 3,9 meq O2/kg. Por otro lado, el método utilizado para la obtención del aceite fue prensado en frío y registraron un valor de 3,74 meq O2/kg.
|
Tabla 5. Índice del iodo |
|||
|
Promedio |
8,8545 g yodo/100 g muestra |
Índice de yodo |
Tipo de Aceite |
|
Desv. Estándar |
0,0914 |
≥ 140 |
Secante |
|
CV |
1,0327 % |
110 - 140 |
Semi-secante |
|
|
|
< 110 |
No secante |
Característica esencial de los aceites no secantes es que a temperatura ambiente no se polimerizan, esta particularidad la presentan los aceites secantes y semi-secantes que al ser polimerizados generan una película resistente y brillante por oxigenación del aire (polimerización). El aceite de Neem es un aceite no secante debido a que no presentan producción de ácidos grasos insaturados. Por otro lado, el índice de yodo depende del número medio de dobles enlaces por moléculas y el peso molecular medio del aceite, por lo que el índice es mayor mientras mayor sea el número de dobles enlaces por unidad de grasa o aceite. Por lo que se puede indicar que índice obtenido en la presente investigación 8,9 ± 0,0914 y en el estudio realizado por un estudio con un índice yodo para el Neem de 67 g yodo/100 g obtenido por el mismo método. Estas cifras se corroboran con los valores que se encuentra registrados en la clasificación de los aceites según el índice de yodo.
|
Tabla 6. Índice de saponificación |
|
|
Promedio |
183,18 mgKOH/g muestra |
|
Desv. Estándar |
1,17 |
|
CV |
0,640 % |
El índice de saponificación obtenido en este estudio fue de 183,18 ±1,17, es comparable con el obtenido en un estudio realizado cuyo índice de saponificación fue de 169,33 de aceite prensado al frío. Propiedad química que posee el aceite y que puede ser muy útil en la industria para la fabricación de jabones.
|
Tabla 7. Índice de acidez |
|
|
Promedio |
0,2396 mg KOH/g aceite |
|
Desv. Estándar |
0,0199 |
|
CV |
8,2907 % |
Los aceites y grasas no refinados poseen un nivel elevado de ácidos grasos libres, el índice marca el grado de descomposición del aceite, este sirve como indicativo para establecer la condición general del aceite. Por el contrario, los aceites o grasas refinadas contienen cantidad de ácidos grasos libres inferior al 0,05 %, lo que permite explicar en los valores obtenidos para muestra objeto de estudio al ser comparados con otros estudios así tenemos para el caso del Neem 0,24± 0,01; dio como resultado 8,86 mg KOH /g aceite; 5,3 mg KOH/g aceite; 21,7mg KOH /g aceite, en caso del Neem, el ácido graso predominante es el oleico por cada 100 gramos de aceite, sin embargo, por efectos de cálculos para la obtención porcentual se consideró el peso del ácido oleico igual al peso molecular del ácido libre, por lo que este último es el que se tomó como referencia en el empleo de la fórmula.
|
Tabla 8. Índice de refracción |
|
|
Promedio |
1,4662 |
|
Desv. Estándar |
0,0 |
|
CV |
0,0 |
Los valores encontrados para el aceite de Neem en cuanto al índice de refracción fue de 1,4662 ±0,0 poseen aproximación con los reportados cuyas cifras fueron de 1,453.
|
Tabla 9. Pérdida por secado |
|
|
Promedio |
0,0114 % |
|
Desv. Estándar |
0,004 |
|
CV |
39,855 |
Debido a que la presencia de humedad en una muestra es un índice de estabilidad, se realizó este análisis (pérdida por calentamiento) para determinar el contenido de humedad y otras materias volátiles que se pueden encontrar presentes en las grasas y aceites animales o vegetales. El método de la estufa es aplicable únicamente a los aceites no secantes (NTE INEN 0039) USP 26
Rendimiento de los aceites
Para establecer el rendimiento del aceite en la extracción se mantuvo un peso aproximado en cada una de ellas, fijando la cantidad de solvente, temperatura y el tiempo de extracción que fue de 3 horas.
De los datos que constan en la tabla se puede observar que se obtuvo 50 g de aceite a partir del peso promedio de 50g de semillas lo que equivale al 92 % de recuperación. Lo que se contrapone con los resultados obtenidos por un estudio en la que los resultados a partir de 35 g de semilla tuvieron como promedio 21,64 g de aceite lo que representaba el 62 % de recuperación. La diferencia en el porcentaje de rendimiento en ambos estudios posiblemente se deba a los solventes utilizados en las extracciones, en el que el rendimiento de la extracción del aceite de la semilla de Neem arrojó el siguiente orden: hexano éter de petróleo > etanol prensado.
Tamaño de la herida
A partir de los valores registrados en los diferentes días de evaluación con respecto a la cicatrización de las heridas inducidas en las ratas, se pudo observar en el primer día que todos los grupos de los diferentes tratamientos presentaban un tamaño de 10 mm ±0. En cuanto a los valores presentados en lo que respecta a humedad e inflamación presentaban 100 % todos los animales; característico de la producción de una herida. En el segundo día de análisis en cuanto a los valores del tamaño de la herida los grupos no presentaron diferencias significativas así tenemos que el grupo G: control Moringa 30 µ presentaba un promedio (9,83±0,41); B: control negativo (9,67±0,52); E: control Neem 60 µ (9,67±0,52); F: control Neem 120 µ (9,67±0,52); I: control Moringa 120 µ (9,67±0,52) A : control normal ( 9,5±0,84); C: control positivo (9,5±0,55); H: control Moringa 60 µ (9,5±0,55); y el grupo D: control Neem 30 µ (9,33±0,52) . Así tenemos que el día tres los promedios reportados fueron grupo B: control negativo (9,67±0,52); E: control Neem 60 µ (9,67±0,52); I: control Moringa 120 µ (9,50±0,84); F: control Neem 120 µ (9,5±0,55); G: control Moringa 30 µ (9,33±0,82); C: control positivo (9,17±0,75); D: control Neem 30 µ (9,17±0,41); A: control normal (9±0,89); y el grupo H: control Moringa 60 µ (9±0,89). En el cuarto día los promedios reportados fueron grupo B: control negativo (8,83±0,75); A: control normal (8,67±1,21); G: control Moringa 30 µ (8,5±1,22); I: control Moringa 120 µ (8,33±1,37); F: control Neem 120 µ (8,17±1,17); D: control Neem 30 µ (8,17±0,98); E: control Neem 60 µ (8,17±0,75); H: control Moringa 60 µ (8,17±0,41); C: control positivo (7,5±0,84). En el quinto día los promedios fueron, grupo B: control negativo (8,67±0,82); A: control normal (8,33±1,37); I: control Moringa 120 µ (8,33±1,37); F: control Neem 120 µ (8,17±1,17); G: control Moringa 30 µ (8±1,10); E: control Neem 60 µ (7,83±0,75); D: control Neem 30 µ (7,67±0,52); H: control Moringa 60 µ (7,67±0,52); C: control positivo (7,17±0,98). Esta tendencia de no presentar diferencia entre grupos se mantuvo hasta el quinto día.
|
Tabla 11. Promedio del tamaño de la herida (mm) de los grupos que presentaron diferencias estadísticas entre los días seis y siete de evaluación |
||||
|
Día Tratamiento |
6 |
Diferencia Estadística* |
7 |
Diferencia Estadística* |
|
A: control normal |
8±1,41 |
A |
7,67±1,21 |
A |
|
B: control negativo |
8±0,89 |
A |
7,67±1,03 |
A |
|
C: control positivo |
6,67±0,52 |
B |
6,33±0,82 |
B |
|
D: control Neem 30 µ |
6,5±0,55 |
B |
6±0,63 |
B |
|
E: control Neem 60 µ |
6,83±1,47 |
AB |
6,33±1,03 |
B |
|
F: control Neem 120 µ |
7,5±1,38 |
AB |
6,67±1,03 |
AB |
|
G: control Moringa 30 µ |
8±1,10 |
A |
7,67±0,82 |
A |
|
H: control Moringa 60 µ |
6,83±0,41 |
AB |
6,5±0,84 |
B |
|
I: control Moringa 120 µ |
8±1,26 |
A |
7±0,89 |
AB |
|
*Columna que tienen la misma letra no presenta diferencia estadística (P<0,05) |
||||
Sin embargo, el día seis y siete de acuerdo al análisis realizado se encontró diferencia entre los grupos. Tal como se encuentran registrados en la tabla 11.
Estos resultados están relacionados con el proceso de cicatrización que consiste en cuatro fases interconectadas y dependientes de la activación y de la acción celular que estimulan el crecimiento, reparación y remodelación que favorecen las condiciones normales del tejido.
Este proceso de cierre de la herida probablemente se deba a que los fibroblastos sufren una serie de cambios fenotípicos, en la que primero se observa un fenotipo migratorio, profibróticos con producción den colágeno y el noveno día de cicatrización normal, se presentan fenotipos de miofibroblastos con abundante actina, estableciéndose uniones entre células adherentes. El colágeno formado se une a través de enlaces covalentes cruzados con haces del borde de la herida y con haces de la dermis adyacente. Estas uniones crean una red a través de la herida. La proteína “factor de crecimiento transformante (TGF) β” estimula la contracción de los fibroblastos y la adhesión celular, además angiotensina, actúan en este proceso las prostaglandinas, la bradiquinina y la endotelina, en fase final de la cicatrización los fibroblastos inician su proceso de apoptosis, se establece una transición de una cicatriz rica en fibroblastos y tejido de granulación, a una cicatriz acelular.
Humedad
El primer día de tratamiento todos los grupos no presentaron ninguna diferencia estadística manteniéndose en un 100 %, figura 2.
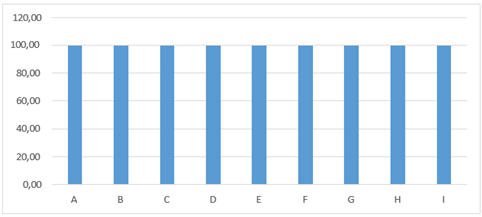
Figura 2. Promedios de los porcentajes de humedad que presentaron los grupos tratados en el día uno de evaluación
En el día dos de evaluación existió diferencia estadística entre los grupos, en el cual el grupo C: 78,33± 7,53; F: 75,00± 5,48; E: 73,33± 5,16; fueron los que presentaron menor porcentaje de humedad en relación a los demás grupos, ya que, el grupo B: 100,00±0, continuo con un 100 % de humedad y los grupos A: 98,33± 4,08; I: 96,67± 5,16; G: 93,33± 8,16; H: 88,33± 7,53; D: 81,67± 7,53; presentaron mayor porcentaje de humedad figura 3.
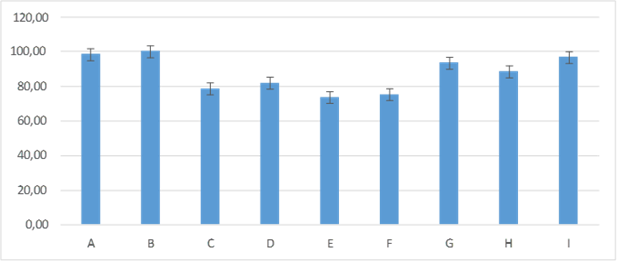
Figura 3. Promedios de los porcentajes de humedad que presentaron los grupos tratados en el día dos de evaluación
En el día tres de evaluación los grupos C: 70,00± 8,94; F: 65,00± 5,48; E: 60,00± 6,32; el porcentaje de humedad fue menor en relación a los demás grupos, presentando diferencias con el resto de los grupos B: 86,67± 5,16; A: 85,00± 5,48; I: 83,33± 8,16; G: 78,33± 7,53; H: 75,00± 5,48; D: 71,67± 7,53; en los que se puede observar un porcentaje mayor figura 4.
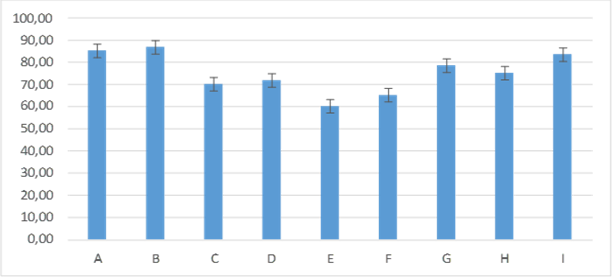
Figura 4. Promedios de los porcentajes de humedad que presentaron los grupos tratados en el día tres de evaluación
En el día cuatro de experimentación el grupo E: 40,00 ± 8,94 continúa siendo el grupo que presenta menor porcentaje de humedad presentando una marcada diferencia estadística con el grupo B: 75,00± 5,48; demostrando mayor porcentaje con relación a los demás grupos, grupos A: 73,33± 8,16; I: 71,67± 9,83; G: 65,00± 10,49; D: 61,67± 9,83; H: 61,67± 7,53; C: 56,67± 15,06; F:51,67± 11,69; figura 5.
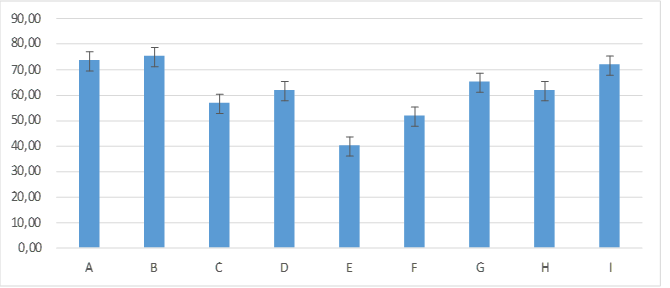
Figura 5. Promedios de los porcentajes de humedad que presentaron los grupos tratados en el día cuatro de evaluación
Para el día cinco de evaluación la tendencia se mantiene siendo el menor porcentaje para el grupo E: 21,67± 7,53 y el mayor porcentaje para el grupo B: 58,33± 11,69; los demás grupos, A: 56,67± 12,11; I: 51,67± 16,02; G: 50,00±14,14; D: 43,33± 12,11; H: 43,33± 12,11; C: 36,67± 12,11; F: 31,67± 7,53, presentando diferencias estadísticas entre grupos figura 6.
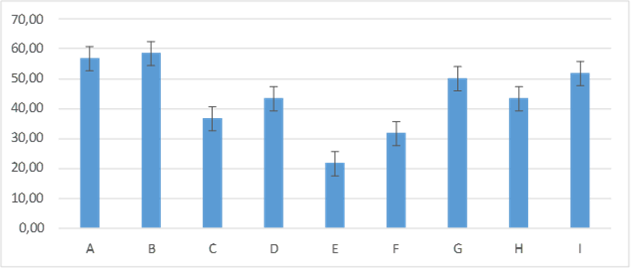
Figura 6. Promedios de los porcentajes de humedad que presentaron los grupos tratados en el día cinco de evaluación
En el día seis de evaluación los porcentajes presentado por los grupos fueron los siguientes: E: 10,83± 4,92 (menor porcentaje) y el grupo B: 48,33± 11,69 (mayor porcentaje de humedad); con relación a los demás grupos, A: 45,00± 10,49; I: 38,33± 14,72; G: 36,67± 10,33; H: 30,00± 8,94; D: 25,00± 5,48; C:21,67± 7,53; F: 16,67± 5,16; manteniéndose la diferencia estadística entre grupos figura 7.
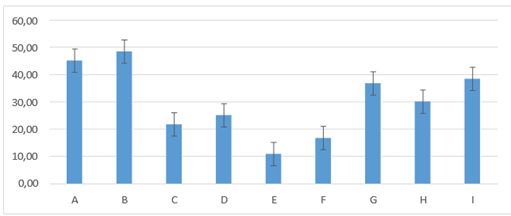
Figura 7. Promedios de los porcentajes de humedad que presentaron los grupos tratados en el día seis de evaluación
En el día siete de evaluación estos resultados se mantuvieron siendo que el grupo E: 0,83± 2,04 (menor porcentaje de humedad) y el grupo B: 31,67± 11,69 (mayor porcentaje) en relación a los demás grupos presentando una gran diferencia estadística entre estos dos valores, mientras que los demás grupos los porcentajes demostrados fueron: A: 25,00±10,49; I: 23,33± 10,33; G: 21,67± 11,69; H: 16,67± 5,16; D: 11,67± 4,08; C: 4,17± 3,76; F: 1,67± 2,58 figura 8.
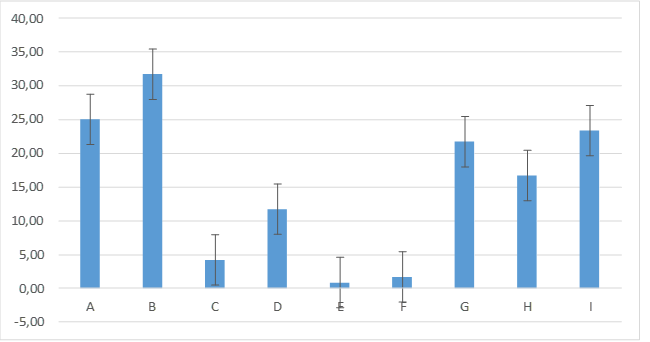
Figura 8. Promedios de los porcentajes de humedad que presentaron los grupos tratados en el día siete de evaluación
Dentro de ciertos límites, un nivel de humedad controlado mejora la síntesis de colágeno y aumenta el grado de granulación y epitelización, acortando los plazos de cicatrización. La presencia de humedad en una herida conlleva a que en la piel se presente eritema e inflamación, con la producción de una erosión, superficial o poco profundas, y se produce pérdida de las capas más superficiales de la piel, que se sitúan en sitios expuestos a un exceso de humedad. Adicionalmente, se presenta bordes difusos, con formas indefinidas, apareciendo frecuentemente más de una herida cercana, y suelen estar acompañadas de un eritema que se presenta como blanqueable a la presión digital, y que se distribuye a ambos lados de un pliegue cutáneo.
Una de las primeras etapas en el proceso de cicatrización son mediadores que intervienen en la inflamación, así tenemos que histamina, es la encargada de incrementar la permeabilidad capilar para que los elementos de la serie blanca puedan migrar y los vasos sanguíneos permitan la salida de más líquido. El exceso de líquido penetra en la herida, formando la base del exudado, que puede persistir y ser excesiva debido a la existencia continua de procesos inflamatorios, Aunque un <las condiciones de humedad o sequedad extrema afectan de forma negativa a la cicatrización. Por otra parte, Aquellas heridas que no cicatrizan (heridas crónicas), parece que el exudado tiene efectos opuestos. Este exudado contiene concentraciones elevadas de mediadores inflamatorios y metaloproteínas (MMP) activadas.
Inflamación
En el primer día que se provocó la lesión los promedios de los porcentajes observados fue de 100 para todos los grupos. Tal como lo muestra el figura 9.
Figura 9. Promedios de los porcentajes de inflamación que presentaron los grupos tratados en el primer día de evaluación
En el día dos de evaluación de los diferentes tratamientos que fueron aplicados en los animales presentaron diferencias estadísticas entre los grupos. Así tenemos que los porcentajes presentados para los grupos I: control Moringa 120 µ (90,00±6,32); H: control Moringa 60 µ (88,33±7,53); G: control Moringa 30 µ (86,67±8,16); C: control positivo (85,00±5,48). A partir del análisis se puede establecer que las diferentes concentraciones ensayadas con el aceite de Neem presentaron una marcada diferencia con relación a los grupos; siendo que, el grupo F: control Neem 120 µ (75,00±5,48) tratado con una concentración de 2,19mg/ml fue el de menor porcentaje de inflamación presentado seguido de los grupos D: control Neem 30 µ (80,00±6,32) y E: control Neem 60 µ (76,67±12,11). Por otra parte, el grupo A: control normal (100±0) y B: control negativo (100±0), en sus valores no presentaron diferencia estadística. En cuanto a los grupos que se les aplicó el aceite de Moringa presentaron diferencia con el resto de los grupos presentando proximidad con los grupos controles figura 10.
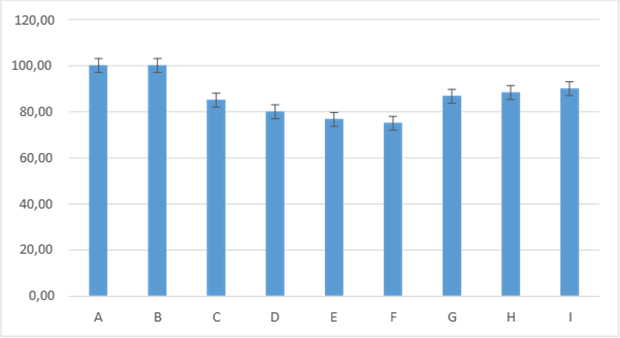
Figura 10. Promedios de los porcentajes de inflamación que presentaron los grupos tratados en el segundo día de evaluación
En el día tres los resultados mostraron que el grupo B: 100±0,0; A: 91,67±9,83 no presentaron diferencia entre grupos con un mayor porcentaje. Así como también, los grupos I: 78,33± 4,08; G: 73,33 ± 8,16; H: 73,33 ± 5,16; D: 71,67±7,53; C: 68,33±9,83; F: 65,00± 5,48; no presentaron diferencias entre estos grupos. Por el contrario, el grupo E: 53,33 ± 5,16; presentó menor porcentaje de inflamación en relación a los demás grupos tratados figura 11.
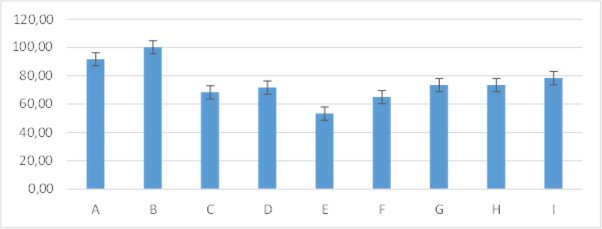
Figura 11. Promedios de los porcentajes de inflamación que presentaron los grupos tratados en el día tres de evaluación
En el día cuatro, aunque los porcentajes se encontraban ligeramente disminuidos en los grupos A y B no presentaban diferencia con relación a los grupos I: 76,67±5,16; G: 71,67±7,53. Un porcentaje menor se observó en los grupos: D: 55,00±5,48; H: 55,00±5,48; C: 53,33±8,16; los cuales no se observó diferencia. Sin embargo, se pudo notar una notable disminución con marcada diferencia en los grupos: F: 43,33±8,16; E: 38,33± 7,53 figura 12.
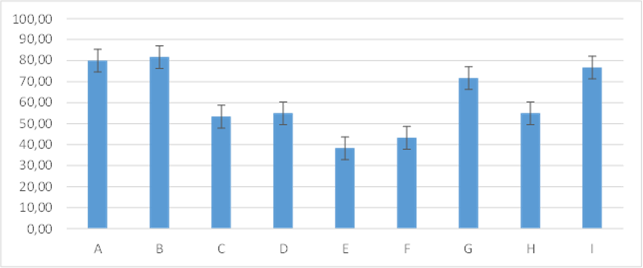
Figura 12. Promedios de los porcentajes de inflamación que presentaron los grupos tratados en el día cuatro de evaluación
En cuanto al día cinco, los porcentajes calculados mostraron que no existía diferencia entre los siguientes grupos: D: 36,67± 8,16; C: 31,67± 9,83; F: 30,00±8,94; E: 25,00± 5,48; encontrándose diferencia con los grupos: G: 56,67± 8,16;H: 48,33± 9,83. Los grupos B: 75,00± 8,37; A: 68,33± 9,83; I: 65,00± 8,37,expresaron un porcentaje superior de inflamación diferencia estadística con relación a los demás grupos figura 13.
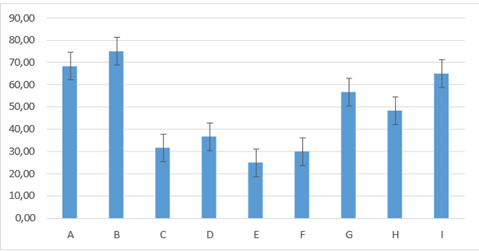
Figura 13. Promedios de los porcentajes de inflamación que presentaron los grupos tratados en el cuarto día de evaluación
Para el día seis la tendencia estadística se mantiene entre los diferentes grupos tratados. El grupo C: 20,00± 8,94; F: 16,67 ± 8,16; E: 10,00± 5,48; mostrando menor porcentaje. Para los grupos G: 48,33 ± 11,69; H; 43,33 ± 13,66; D: 33,33± 12,11; no existió diferencia estadística entre grupos. Pero, se observó un mayor porcentaje en los grupos: B: 66,67± 5,16; A: 60,00±10,95; I: 60,00 ± 8,94 diferenciando entre los demás grupos de experimentación figura 14.
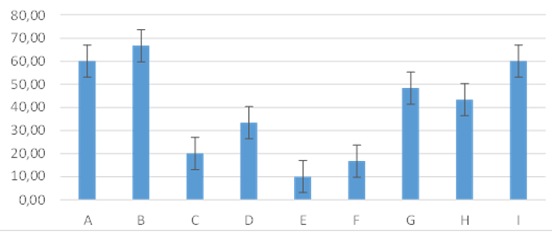
Figura 14. Promedios de los porcentajes de inflamación que presentaron los grupos tratados en el día seis de evaluación
En el día siete de evaluación la diferenciación estadística no se modificó con relación al día seis. Siendo los porcentajes encontrados para los diferentes tratamientos los siguientes: grupo G: 40,00 ± 8,94; H: 36,67 ± 8,16; D: 23,33 ± 8,16; C: 15,83 ± 9,17; E: 2,50 ± 2,74. Para los grupos B: 51,67 ± 7,53; A:45,00±10,49; I: 43,33 ± 8,16 en la que los valores se encuentran incrementados con relación a los demás grupos figura 15.
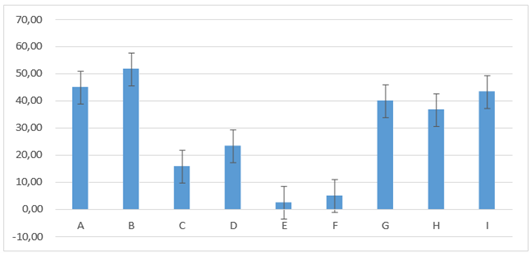
Figura 15. Promedios de los porcentajes de inflamación que presentaron los grupos tratados en el día siete de evaluación
Costra
En los dos primeros días de tratamiento no se registró presencia de costra en ninguno de los animales estudiados.
En el día tres los grupos E: 23,33±8,16; F: 21,67± 11,69; C: 18,33± 11,69; D: 16,67± 8,16 fueron los que presentaron mayor porcentaje de costra en relación a los grupos A: 5,00±5,48; G: 5,00± 5,48; H: 5,00± 4,47; I: 2,50±2,74; B: 0,00; presentando diferencia entre ellos figura 16.
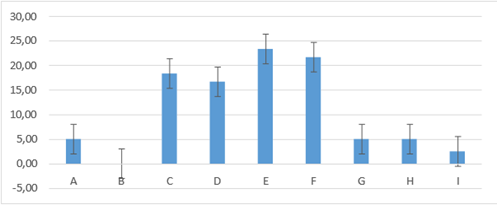
Figura 16. Promedios de los porcentajes de costra que presentaron los grupos tratados en el día tres de evaluación
En el día cuatro los grupos E :41,67 ±17,22; C:40,00± 15,49 son los que presentaron mayor porcentaje de costra con relación a los demás grupos, estableciendo diferencias con los grupos D: 30,00± 27,57; F:30,00 ± 14,14; A:25,83± 20,84, mientras que los grupos G:20,00± 6,32; H:11,67± 5,16; I:10,00±5,48; B: 5,83± 2,04, el porcentaje fue menor con relación a los demás grupos tratados figura 17.
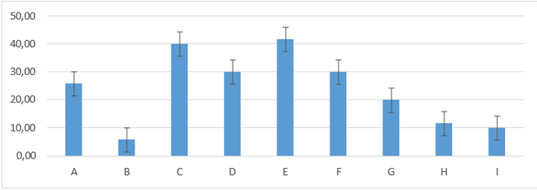
Figura 17. Promedios de los porcentajes de costra que presentaron los grupos tratados en el día cuatro de evaluación
En el día cinco el porcentaje se incrementó en los grupos E: 65,00± 17,61; C: 63,33± 18,62; F: 53,33± 12,11; se estableció diferencia con los grupos D: 46,67±19,66; A: 34,17± 22,45, siendo que los grupos G: 23,33± 5,16; I: 21,67± 11,69; H: 20,00± 8,94; B: 11,67± 2,58 la presencia de costra fue menor en relación a los demás grupos figura 18.
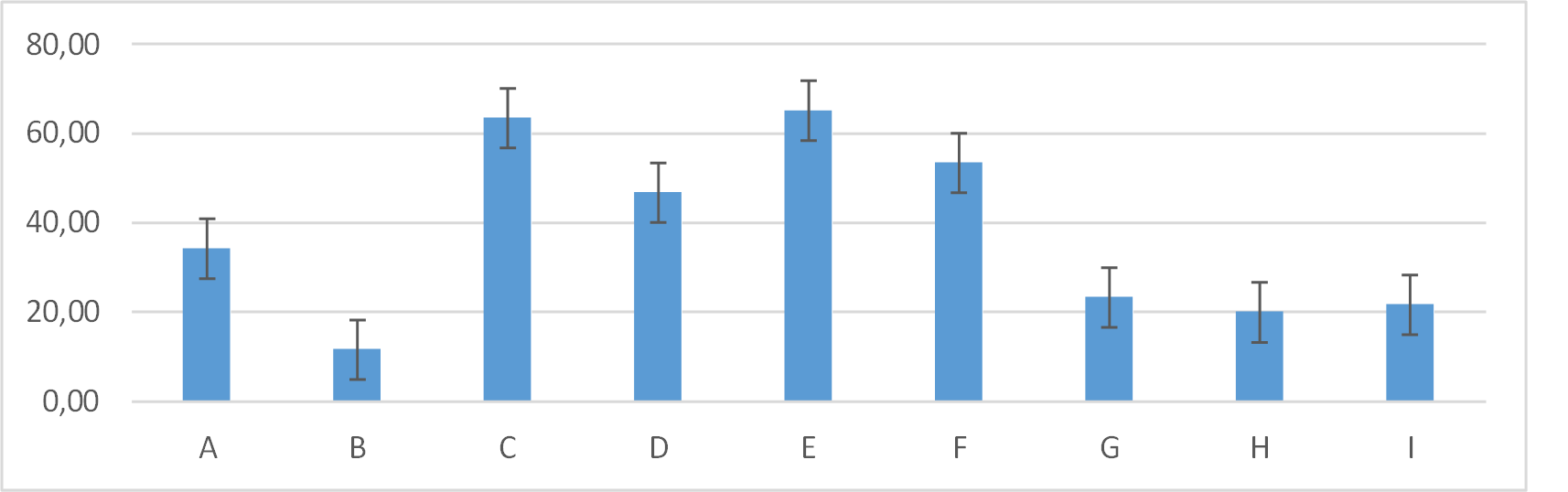
Figura 18. Promedios de los porcentajes de costra que presentaron los grupos tratados en el día cinco de evaluación
En el día seis de evaluación el grupo E: 100,00±0,00 llegó al 100 % de costra, los grupos F: 91,67± 13,29; C: 88,33± 13,29; D: 81,67 ± 20,41 no presentaron diferencia entre grupos. Sin embargo, los grupos A: 55,00± 25,10; G: 41,67±11,69; I: 36,67±8,16; H: 33,33± 10,33; B: 33,33± 5,16; presentaron unmenor porcentaje de costra presentando diferencia estadística entre grupo figura 19.
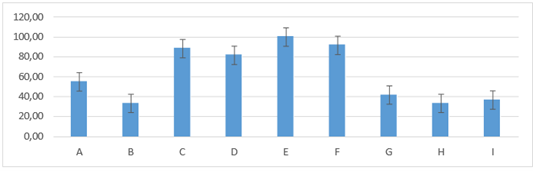
Figura 19. Promedios de los porcentajes de costra que presentaron los grupos tratados en el día seis de evaluación
En el día siete de evaluación el grupo E: 100,00±0,00 se mantuvo en 100 % de costra, mientras que los grupos F: 98,33± 4,08; D: 96,67± 5,16; C: 95,00± 8,37. Seguido del grupo A: 83,33± 16,33. En tanto que los grupos G: 58,33± 9,83; I: 55,00± 8,37; H: 53,33± 8,16; B: 48,33± 7,53 presentaron diferencia entre grupos con una p< 0,05 figura 20.
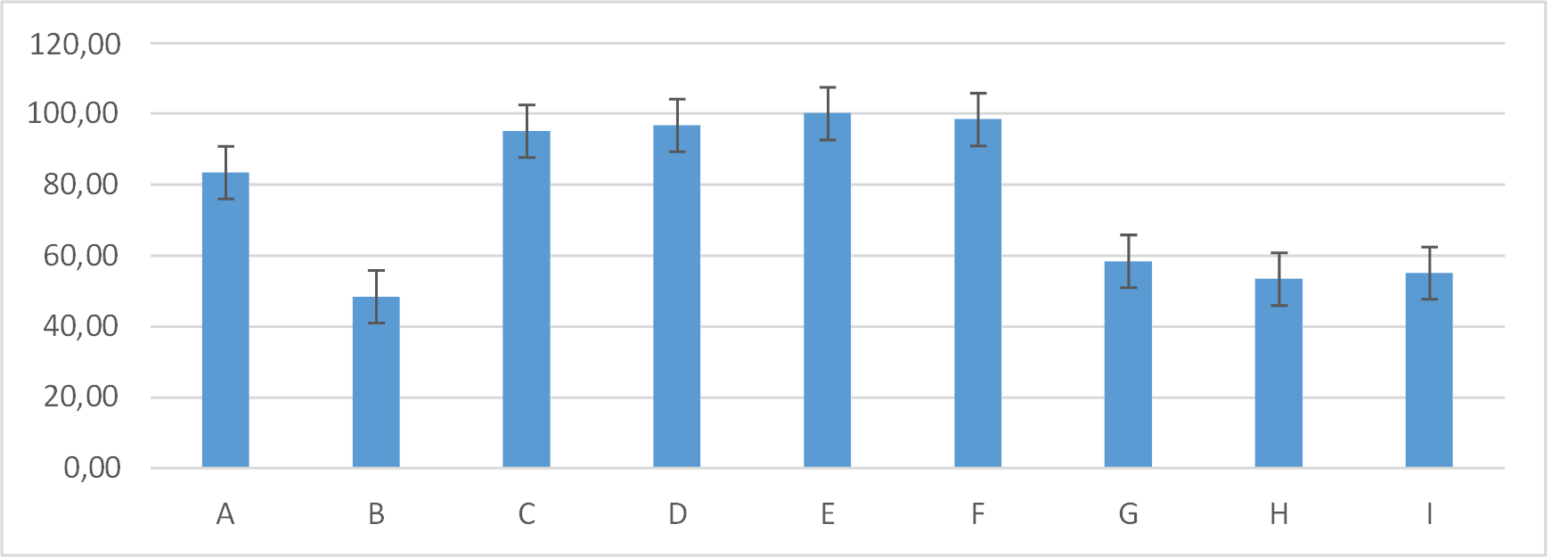
Figura 20. Promedios de los porcentajes de costra que presentaron los grupos tratados en el día siete de evaluación
Con los datos expuestos se puede deducir que el proceso de cicatrización observado para los grupos tratados se debe a que en la tercera fase se puso de manifiesto la proliferación derivada del proceso de inflamación y precursora de la fase de maduración; se inicia hacia el tercer día y dura aproximadamente de 15 a 20 días en este periodo de tiempo se genera una barrera protectora, para aumentar los procesos regenerativo se impedir el ingreso de agentes nocivos; esta es la fase de “Contracción de la herida” y empieza cuando los macrófagos comienzan a digerir los microorganismos y sobreviven al ataque de los neutrófilos. Con esto se explica la formación de costra que después de las 24 h de la lesión, comienzan a proliferar los fibroblastos y las células endoteliales, que forman en un período de 3 a 5 d, un tejido especializado (tejido de granulación) siendo primordial para la cicatrización. Finalmente, este tejido da lugar a una cicatriz formada por fibroblastos fusiformes, colágeno, denso, fragmentos de tejido elástico, matriz extracelular, reparación de las células parenquimatosas, emigración y proliferación de las células parenquimatosas y conjuntivas, síntesis de proteínas de la matriz extracelular, remodelación del tejido conjuntivo y elementos parenquimatosos, colagenización.
Estudios histopatológicos
Figura 21. Promedio porcentual de células presentes en muestras de piel tomada de los animales tratados en las diferentes fases de cicatrización: Humedad
En la figura 21 luego de realizar la tinción, fijación y observación en el microscopio, se encontraron en los grupos B, A, I células abundantes como los polimorfonucleares y en menor cantidad células epiteliales. En los grupos G, H, D presentaron tejido granular, fibroblastos, células epiteliales. En los últimos grupos C, F, E se encontró abundante presencia de leucocitos polimorfonucleares, miofibroblastos, tejido granular.
Producido un daño en la piel las membranas celulares liberan factores como tromboxano y prostaglandina que hace que el vaso se contraiga y disminuya pérdida de sangre, este proceso de vasoconstricción dura aproximadamente de 5 a 10 minutos seguido por una vasodilatación es producida por la histamina alcanzando su máximo efecto en 20 minutos después de producida la herida. La histamina hace que el tejido se torne edematoso y forme vasos sanguíneos porosos debido a que las proteínas que aporta al espacio extravascular del torrente sanguíneo aumenten la carga osmolar y con ello aporte agua a la zona. Transcurrida una hora de haberse producido la herida los polimorfosnucleares se convierten en células más abundantes en la zona de la herida dentro de los primeros días .En esta fase existe la formación de la matriz extracelular mediante la secreción de abundante colágeno, se fagocitan y se eliminan las bacterias y suciedad, liberándose factores que producen migración y división de células llevándose a cabo la fase proliferativa donde existe la formación del tejido granular, epitelización, contracción de herida que dan lugar a: 1) procesos angiogénesis crecen nuevos vasos sanguíneos a partir de células endoteliales. 2) Fibroplasia y formación del tejido granular. 3) epitelización: las células se desplazan sobre la herida cubriéndola. 4) en la contracción se forman los miofibroblastos que ayudan a reducir el tamaño de la herida. Este proceso se observa entre 0 y día el día 2.
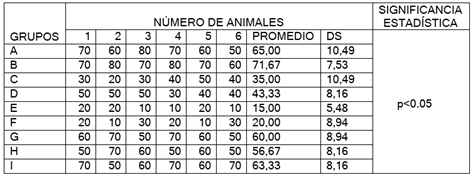
Figura 22. Promedio porcentual de células presentes en muestras de piel tomada de los animales tratados en las diferentes fases de cicatrización: Inflamación
En la figura 22 luego de realizar la tinción, fijación y observación en el microscopio. Se encontraron en los grupos B, A, I abundantes presencia de monocitos y polimorfonucleares. En los grupos G, H, D presencia de monocitos y macrófagos, y en los grupos C, F, E abundante presencia de macrófagos.
Luego de dos días de producida la herida los monocitos son las células que alcanzan su máxima proporción que luego maduran y se transforman en macrófagos que es la célula responsable de ejercer la función fagocitaria de bacterias y tejido dañado; los macrófagos secretan las citoquinas que ayudan a la fase de proliferación de cicatrización de la herida.
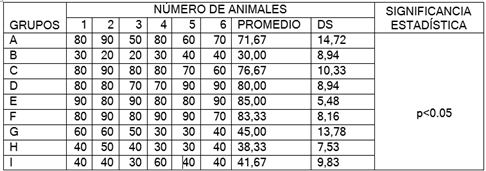
Figura 23. Promedio porcentual de células presentes en muestras de piel tomada de los animales tratados en las diferentes fases de cicatrización: Costra
En la figura 23 luego de realizar la tinción, fijación y observación en el microscopio. Se encontraron en los grupos I, H, B se encuentran numerosos monocitos y escasa presencia de macrófago, en los grupos C, A, G presencia de macrófagos y de células epiteliales y los grupos E, F, D abundante presencia de fibroblastos, células endoteliales, células epiteliales.
Existen factores que intervienen en la cicatrización y que habría que considerar así tenemos:
1) Las heridas que cicatrizan en un medio “seco” presentan mayor superficie de muerte tisular que la que provoca la propia herida (proceso denominado “necrosis por deshidratación”). Por otro lado, en un medio húmedo se incrementa el aporte de oxígeno y nutrientes vía endógena. Así también, cuando el nervio es lesionado, existe un aumento de macrófagos y neutrófilos que estimula la angiogénesis en el nervio dañado. A los cinco días de producida la lesión, con la formación de vasos sanguíneos se producen dos muñones proximal y distal del nervio. En el sexto día se observan redes vasculares unidas entre sí, es decir que se anastomosan.
2) Las células epiteliales en presencia de humedad progresan más rápido; la existencia de enzimas proteolíticas y factores de crecimiento funcionales (polipéptidos) en el fluido que se encuentra en la superficie de la herida promueven la proliferación y migración celular que ayudan al proceso de cicatrización. Además, Como producto de la acción de los fibroblastos y enzimas colagenasas existen una mayor elaboración síntesis de colágeno.
CONCLUSIONES
Por lo anteriormente, expuesto y de acuerdo con los objetivos planteados se puede concluir lo siguiente:
1) Al realizar los análisis físicos químicos al aceite de Neem se pudo evidenciar que la mayoría de los resultados correspondían con los estudios encontrados en la literatura. Así tenemos que: Densidad 0,878 característica de los aceites; pH 5,915; I. Peróxido 1,9935; I. Yodo 8,8545; I. Saponificación 183,18; I. Acidez 0,2396; I. Refracción 1,4662; Pérdida por secado 0,0114; Rendimiento 24,6469.
2) De acuerdo con los resultados obtenidos se puede deducir que el aceite de Neem concentración de 4,38 mg/ml en un volumen de (60 µl) presentó un mayor efecto de cicatrización. Se tomó en consideración, variables como: tamaño de la herida, presencia de exudado (humedad), inflamación, presencia de costra. En lo que corresponde al tamaño de la herida se visualizó una disminución significativa en el cuarto día. Referente a la humedad a partir del segundo día el porcentaje fue de 73 y continuó con esta tendencia decreciente, así se pudo observar que en el día siete no existía presencia de humedad. En un proceso de cicatrización la inflamación está directamente relacionada con la humedad, así notamos que en el segundo día presentó un porcentaje 76 el cual disminuyó paulatinamente a cero % al final del estudio. En cuanto a la presencia de costra, se pudo comprobar que en el tercer día tuvo un porcentaje de 20 y en el día seis llegó al 100 %, lo que se traduce como una evolución favorable en la cicatrización. Por otro lado con el aceite de Moringa cuya concentración era de 4,48 mg/ml en un volumen de (60 µl) no se observó disminución significativa en cuanto a los parámetros evaluados durante los días de experimentación.
3) La sistematización y periodicidad de las mediciones permitió monitorear y evaluar el impacto de los diferentes tratamientos en la aceleración de la cicatrización. No obstante, debido a que la producción de costra es uno de los componentes fundamentales es que se estimó mediciones porcentuales de la misma. Tomando como referente el grupo control negativo B (sin tratamiento); con un comportamiento de cicatrización natural se pudo observar que no hubo presencia de costra hasta el tercer día, y al término de la experimentación presentó un 40 %. Sin embargo, los grupos tratados con Neem en diferentes concentraciones (D, E, F) mostraron presencia de costra en tercer día, de tal forma que en el día seis el grupo E presentaba el 100 %, mientras que los grupos D, F en el día seis presentaban el 80 % y en el día siete presentaron el 100 %, esto últimos resultados son comparables a los presentados por el grupo C (control positivo/yodo). Por el contrario, los grupos (G,H) tratados con Moringa en diferente concentraciones se notó la presencia de costra a partir del tercer día 10 %,en tanto que el grupo I presentó costra en el día cuarto, al término de la prueba se observó un porcentaje 60 en los tres grupos. Por lo expuesto, se puede concluir que los grupos a los que se le aplicó Neem fueron los que presentaron mayor aceleración en el proceso de cicatrización dentro del periodo de experimentación.
4) La aceleración de la cicatrización se puede correlacionar con los hallazgos histopatológicos de las diferentes muestras tomadas y la presencia de células características de la fase proliferativa con producción de costra.
RECOMENDACIONES
· Siendo el valor índice de acidez y el peróxido un buen indicador de la calidad del aceite, este pudo verse influenciado por el tiempo que duró la rotaevaporación, y la temperatura del baño, sería conveniente repetir las pruebas para reproducir los resultados y verificar si constituyen un factor crítico dentro del análisis. En caso de obtener valores aproximados se podría considerar como característicos de nuestra variedad. Para esto se debe tomar como referencia que un aceite fresco debe tener valores menores a 1.
· Se deben realizar pruebas de irritación y de sensibilización dérmica, para definir cuál es el margen de seguridad de uso sin que produzca efectos adversos.
· Siendo una especie vegetal que crece de forma silvestre se hace necesario crear una forma farmacéutica a partir de los datos generados de la irritación y sensibilización dérmica.
· Una evaluación conveniente de la herida es el primer paso para seleccionar el tratamiento ideal. El tipo de herida es un indicativo sobre las fases del proceso de cicatrización y un parámetro para seleccionar los productos para la curación.
REFERENCIAS BIBLIOGRÁFICAS
1. Abiodum O, Adegbite J, Omolola A. Chemical and Physicochemical properties of Moringa flours and oil. Global Journal of Science. 2012. Disponible en: https://globaljournals.org/GJSFR_Volume12/2-Chemical-and-Physicochemical.pdf
2. Andrade G. Obtención y caracterización de un aceite vegetal a nivel de laboratorio a partir de la fruta Amazónica Morete. [Tesis inédita de grado]. Quito; 2015. Disponible en: http://www.dspace.uce.edu.ec/bitstream/25000/4784/1/T-UCE-0017-138.pdf
3. Angamarca M. Factores de riesgo para dehiscencia de herida quirúrgica de la pared abdominal en pacientes atendidos en el área de cirugía general del Hospital Isidro Ayora de Loja en el periodo comprendido entre enero del 2012 a julio del 2012. [Tesis inédita de grado]. Loja, Ecuador; 2012. Disponible en: http://dspace.unl.edu.ec/jspui/bitstream/123456789/6695/1/Angamarca%20Angamarca%20Magaly%20Gabriela.pdf
4. Aníbal F. Manual de farmacología de las infecciones, micosis, parasitosis y neoplasias. México: Editorial UAA; 2013. Disponible en: https://issuu.com/editorialuaa/docs/manual_farmacologia_infecciones
5. ANT. Lesionados diciembre 2015. 2015. Disponible en: http://www.ant.gob.ec/index.php/descargable/file/3369-lesionados-diciembre-2015
6. Arias. Estudio de las posibles zonas de introducción de la Moringa Oleífera Lam. en la península ibérica, islas Baleares e islas Canarias. [Tesis inédita de grado]. Madrid, España; 2014. Disponible en: http://oa.upm.es/23094/1/PFCARIAS_SABIN.pdf
7. Arias D, Vásquez G, Montanez L, Álvarez R, Pérez V. Determinación de Azadirachta de los aceites esenciales del árbol de Neem (Azadirachta indica). INGENIERÍA UC. 2009;16(3):22-6. Disponible en: http://www.redalyc.org/pdf/707/70717551004.pdf
8. Arredondo E. El increíble árbol de Neem. Yoga. 2015. Disponible en: http://revista.ciudadyoga.com/m/medicina-alternativa/530-el-increible-arbol-de-neem
9. Arriola J. Evaluación de tres insecticidas a base de Neem sobre el manejo de adultos de Mosca Blanca (Bemisia tabaci, Aleyrodidae) en pepino; aldea las Tunas, Salamá. [Tesis inédita de grado]. Guatemala de la Asunción, Guatemala; 2013. Disponible en: http://biblio3.url.edu.gt/Tesario/2013/06/14/Arriola-Juan.pdf
10. Asla M. El papel de la nutrición en la cicatrización de las heridas. [Tesis inédita de grado]. 2015. Disponible en: https://addi.ehu.es/bitstream/10810/16049/1/Papel%20de%20la%20nutricion%20en%20la%20cicatrizacion%20de%20las%20heridas.pdf
11. Avalos J. Actividad citotóxica y estudios fitoquímicos de los extractos de semilla y hojas de Neem (Azadirachta indica A. Juss) de origen regional (Ébano, San Luis Potosí) comparada con la comercializada en la India. [Tesis inédita de doctorado]. Torreón Coah, México; 2014. Disponible en: http://eprints.uanl.mx/4002/1/1080253534.pdf
12. Benavides S, Brizuela P, Rivas M. Efecto de Extracto Etílico de propóleo de abeja melífera (Apis mellifera scutellata) como alternativa natural en el proceso de cicatrización de heridas en cabras raza Saanen. [Tesis inédita de grado]. 2016. Disponible en: http://ri.ues.edu.sv/9787/1/13101609.pdf
13. Bonal R, Rivera R, Bolívar M. Moringa oleífera: una opción saludable para el bienestar. Medisan. 2012;16(10). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1029-30192012001000014
14. Bravo E. Detección precoz de infección de herida operatoria postapendicectomías en el Hospital Vicente Corral Moscoso, Cuenca 2012. [Tesis inédita de maestría]. Cuenca, Ecuador; 2013. Disponible en: http://dspace.ucuenca.edu.ec/bitstream/123456789/3996/1/MEDCG10.pdfFINANCIACIÓN
15. Declarar fuente de financiación; caso contrario colocar “Ninguna” o “Los autores no recibieron financiación para el desarrollo de la presente investigación”.
16. Cabrera J. Evaluación del contenido de alcaloides, flavonoides, taninos y aceites esenciales entre tres estados de maduración y recolección de la Moringa Oleífera. [Tesis inédita de grado]. Machala, Ecuador; 2014. Disponible en: http://repositorio.utmachala.edu.ec/jspui/bitstream/48000/1330/7/CD000243-TESIS.pdf
17. Canett-Romero R, Arvayo-Mata K, Ruvalcaba-Garfias N. Aspectos tóxicos más relevantes de Moringa Oleífera y sus posibles daños. Biotecnia. 2014;XVI(2):36-43. Disponible en: http://www.biotecnia.uson.mx/revistas/articulos/26-ARTICULO%207.pdf
18. Carrington S, Cohall D, Gossell W, Lindo J. Tamizaje antimicrobiano de una planta medicinal barbadense con indicaciones para su uso en el tratamiento de infecciones de heridas en diabéticos. West Indian Med. 2012;61(9):861-4. Disponible en: http://caribbean.scielo.org/scielo.php?script=sci_abstract&pid=S0043-31442012000900003&lng=es&nrm=.pf
19. Castro L, Zapata M, Tejada R. Lesión combinada por humedad y presión. Revista Enfermería Docente. 2014. Disponible en: http://www.revistaenfermeriadocente.es/index.php/ENDO/article/view/5/pdf_3
20. Chaput B-S. Animalías de la cicatrización. ScienceDirect. 2012;20:1-13. doi:10.1016/S1634-2143(12)62746-0
21. Dumville J, Walter C, Sharp C, Page T. Apósitos para la prevención de la infección del sitio quirúrgico. Cochrane. 2011. Disponible en: http://www.cochrane.org/es/CD003091/apositos-para-la-prevencion-de-la-infeccion-del-sitio-quirurgico
22. Esquirol J. Curación de heridas, quemaduras y manejo de cicatrices: revisión y papel terapéutico del factor de crecimiento epidérmico (EGF). Barcelona, España; 2015. Disponible en: https://es.fagron.com/sites/default/files/product/document/revision_heridas_quemaduras_cicatrices_je.pdf
23. García F, et al. Clasificación-categorización de las lesiones relacionadas con la dependencia. 2014. Disponible en: http://gneaupp.info/wp-content/uploads/2014/12/clasificacion-categorizacion-de-las-lesiones-relacionadas-con-la-dependencia-segunda-edicion.pdf
24. García J, Vera R. Clasificación de medicamentos del cuadro básico de medicamentos y catálogo que manejan los sistemas de salud en México. 2015. Disponible en: http://www.academia.edu/20725589/clasificaci%C3%B3n_de_f%C3%A1rmacos_por_uso_terap%C3%A9utico_grupo_y_mecanismo_de_accion
25. Guano G. Evaluación de la actividad cicatrizante del extracto de las hojas de tomate (Solanum lycopersicum L) en lesión, inducida en ratones (Mus musculus). [Tesis inédita de grado]. Ribamba, Ecuador; 2015. Disponible en: http://dspace.espoch.edu.ec/bitstream/123456789/4576/1/56T00591%20UDCTFC.pdf
26. Guarín C, Quiroga P, Landínez N. Proceso de cicatrización de heridas de piel, campos endógenos y su relación con las heridas crónicas. Rev. Fac. Med. 2013;61(4):441-8. Disponible en: http://www.scielo.org.co/pdf/rfmun/v61n4/v61n4a14.pdf
27. Herrera O. Estudio farmacognóstico preliminar de las semillas de Moringa oleífera Lam cultivada en Machala. [Tesis inédita de grado]. Machala, Ecuador; 2015. Disponible en: http://repositorio.utmachala.edu.ec/handle/48000/3775?mode=full
28. Hidalgo L. Obtención del aceite de semilla de Nim por extracción de gasolina natural. 2002. Disponible en: http://repositorio.ug.edu.ec/bitstream/redug/752/1/NIM.pdf
29. Infomed. Términos Farmacológicos. 2011. Disponible en: http://glosario.sld.cu/terminos-farmacologicos/2011/04/29/concentracion/
30. Katzung B. Farmacología básica y clínica. San Francisco: McGraw Hill; 2011.
31. López M. Caracterización de la fracción lipídica extractable de las semillas del árbol de Neem (Azadirachta indica A. Juss) obtenida a nivel laboratorio por lixiviación. [Tesis inédita de grado]. Guatemala; 2012. Disponible en: http://biblioteca.usac.edu.gt/tesis/08/08_1258_Q.pdf
32. Martí M, Estrada S. Enfermería en curación de heridas. Buenos Aires, Argentina; 2012. Disponible en: http://www.roemmers.com.ar/sites/default/files/Cuidados%20de%20Enfermeria%20en%20las%20Heridas.pdf
33. Molina J. Drogas antibacterianas. 2015. Disponible en: http://www.facmed.unam.mx/deptos/microbiologia/bacteriologia/terapeutica.html
34. Navarrete E, Moll C, Droppelmann P, González A. Actualización en el uso de la biopsia de piel por punch. Revista Chilena de Cirugía. 2016. doi:10.1016/j.rchic.2016.05.008
35. Nuñez C. Extracciones con equipo Soxhlet. 2008. Disponible en: http://www.cenunez.com.ar/archivos/39-extraccinconequiposoxhlet.pdf
36. Ochoa K, Padilla R. Estudio comparativo del nivel de conocimiento sobre pie diabético en los pacientes que acuden al club de diabetes en el Hospital Dr. Enrique Garcés vs los pacientes diabéticos que acuden a emergencias de la misma casa de salud. [Tesis inédita de grado]. Quito, Ecuador; 2012. Disponible en: http://repositorio.puce.edu.ec/bitstream/handle/22000/5091/T-PUCE-5318.pdf?sequence=1
37. Organización Mundial de la Salud (OMS). Mordeduras de animales. 2013. Disponible en: http://www.who.int/mediacentre/factsheets/fs373/es/
38. Organización Mundial de la Salud (OMS). Resistencia a los antimicrobianos. 2015. Disponible en: http://www.who.int/mediacentre/factsheets/fs194/es/
39. Padayachee B, Baijnath H. An overview of the medicinal importance of Moringaceae. Journal of Medicinal Plants. 2012;5831-9. doi:10.5897/JMPR12.1187
40. Pizarro M. Estudio del plasma rico en plaquetas (PRP) en la aceleración de la cicatrización, regeneración y formación ósea en la cirugía de los terceros molares inferiores. [Tesis inédita de grado]. Guayaquil, Ecuador; 2014. Disponible en: http://repositorio.ug.edu.ec/bitstream/redug/6319/1/PIZARROmarcelo.pdf
41. Real Academia Española. Diccionario. Madrid: Tricentenario; 2014. Disponible en: http://dle.rae.es/?id=KCceJga
42. Real Academia Española. Diccionario. Tricentenario; 2014. Disponible en: http://dle.rae.es/?id=aWzrvDX
43. Reinke J, Sorg H. Wound repair and regeneration. PubMed. 2012;49(1):35-43. doi:10.1159/000339613
44. Romero C, Vargas M. Extracción del aceite de la semilla (Azadirachta indica). Ciencia. 2005;13(4):464-74. Disponible en: http://200.74.222.178/index.php/ciencia/article/view/9288/9276
45. San Martín Á. Cura de heridas quirúrgicas. 2014. Disponible en: http://academica-e.unavarra.es/bitstream/handle/2454/11280/AguedaSanMartinLoyola.pdf?sequence=1
46. Toledo C. Inflamación: Mediadores químicos. Scielo. 2014. Disponible en: http://www.revistasbolivianas.org.bo/scielo.php?pid=S2304-37682014000400005&script=sci_arttext
47. Ultría F. Extracto foliar acuoso y de aceite de las semillas del árbol de Neem y su valoración antimicrobiana contra cepas de E.coli, Salmonella spp y Listeria monocytogenes de muestras clínicas de la ciudad de Barranquilla, Colombia. [Tesis inédita de maestría]. Barranquilla, Colombia; 2014. Disponible en: http://tesis.luz.edu.ve/tde_arquivos/52/TDE-2015-03-05T10:24:43Z-5597/Publico/utria_navarro_fanny_hassiel.pdf
48. Villalba E. Inflamación I. Revista de Actualización Clínica. 2014. Disponible en: http://www.revistasbolivianas.org.bo/scielo.php?pid=S2304-37682014000400004&script=sci_arttext
49. Zempolich K. Neem principal proposed uses. Estados Unidos; 2015. Disponible en: http://monarchwomenscancercenter.com/hl/?/2010814998/Neem.
FINANCIACIÓN
Los autores no recibieron financiación para el desarrollo de la presente investigación.
CONFLICTO DE INTERÉS
Los autores declaran que no existe conflicto de interés.
CONTRIBUCIÓN DE AUTORÍA
Conceptualización: Alexandra López Barrera, Zoraida Burbano Gómez, Carlos Jefferson Valdiviezo Rogel, Glenda Marcela Sarmiento Tomalá, Francisca Patricia Jimenez Granizo, Pilar Asunción Soledispa Cañarte.
Curación de datos: Alexandra López Barrera, Zoraida Burbano Gómez, Carlos Jefferson Valdiviezo Rogel, Glenda Marcela Sarmiento Tomalá, Francisca Patricia Jimenez Granizo, Pilar Asunción Soledispa Cañarte.
Análisis formal: Alexandra López Barrera, Zoraida Burbano Gómez, Carlos Jefferson Valdiviezo Rogel, Glenda Marcela Sarmiento Tomalá, Francisca Patricia Jimenez Granizo, Pilar Asunción Soledispa Cañarte.
Investigación: Alexandra López Barrera, Zoraida Burbano Gómez, Carlos Jefferson Valdiviezo Rogel, Glenda Marcela Sarmiento Tomalá, Francisca Patricia Jimenez Granizo, Pilar Asunción Soledispa Cañarte.
Metodología: Alexandra López Barrera, Zoraida Burbano Gómez, Carlos Jefferson Valdiviezo Rogel, Glenda Marcela Sarmiento Tomalá, Francisca Patricia Jimenez Granizo, Pilar Asunción Soledispa Cañarte.
Administración del proyecto: Alexandra López Barrera, Zoraida Burbano Gómez, Carlos Jefferson Valdiviezo Rogel, Glenda Marcela Sarmiento Tomalá, Francisca Patricia Jimenez Granizo, Pilar Asunción Soledispa Cañarte.
Recursos: Alexandra López Barrera, Zoraida Burbano Gómez, Carlos Jefferson Valdiviezo Rogel, Glenda Marcela Sarmiento Tomalá, Francisca Patricia Jimenez Granizo, Pilar Asunción Soledispa Cañarte.
Software: Alexandra López Barrera, Zoraida Burbano Gómez, Carlos Jefferson Valdiviezo Rogel, Glenda Marcela Sarmiento Tomalá, Francisca Patricia Jimenez Granizo, Pilar Asunción Soledispa Cañarte.
Supervisión: Alexandra López Barrera, Zoraida Burbano Gómez, Carlos Jefferson Valdiviezo Rogel, Glenda Marcela Sarmiento Tomalá, Francisca Patricia Jimenez Granizo, Pilar Asunción Soledispa Cañarte.
Validación: Alexandra López Barrera, Zoraida Burbano Gómez, Carlos Jefferson Valdiviezo Rogel, Glenda Marcela Sarmiento Tomalá, Francisca Patricia Jimenez Granizo, Pilar Asunción Soledispa Cañarte.
Visualización: Alexandra López Barrera, Zoraida Burbano Gómez, Carlos Jefferson Valdiviezo Rogel, Glenda Marcela Sarmiento Tomalá, Francisca Patricia Jimenez Granizo, Pilar Asunción Soledispa Cañarte.
Redacción – borrador original: Alexandra López Barrera, Zoraida Burbano Gómez, Carlos Jefferson Valdiviezo Rogel, Glenda Marcela Sarmiento Tomalá, Francisca Patricia Jimenez Granizo, Pilar Asunción Soledispa Cañarte.
Redacción – revisión y edición: Alexandra López Barrera, Zoraida Burbano Gómez, Carlos Jefferson Valdiviezo Rogel, Glenda Marcela Sarmiento Tomalá, Francisca Patricia Jimenez Granizo, Pilar Asunción Soledispa Cañarte.