doi: 10.56294/hl202241
ORIGINAL
Determination of the antioxidant effect of cocoa husk powder on lipoperoxidation in biological systems
Determinación del efecto antioxidante de la cascarilla de cacao en polvo sobre la lipoperoxidación en sistemas biológicos
Carlos Jefferson Valdiviezo Rogel1
![]() *, Pilar Asunción
Soledispa Cañarte1
*, Pilar Asunción
Soledispa Cañarte1 ![]() *, Francisca Patricia Jimenez Granizo1
*, Francisca Patricia Jimenez Granizo1
![]() *, Glenda Marcela
Sarmiento Tomalá1
*, Glenda Marcela
Sarmiento Tomalá1 ![]() *, Zoraida Burbano Gómez1
*, Zoraida Burbano Gómez1
![]() *, Alexandra López Barrera1
*, Alexandra López Barrera1
![]() *
*
1Universidad de Guayaquil, Facultad de Ciencias Químicas. Guayaquil, Ecuador.
Citar como: Valdiviezo Rogel CJ, Soledispa Cañarte PA, Jimenez Granizo FP, Sarmiento Tomalá GM, Burbano Gómez Z, López Barrera A. Determination of the antioxidant effect of cocoa husk powder on lipoperoxidation in biological systems. Health Leadership and Quality of Life. 2022; 1:41. https://doi.org/10.56294/hl202241
Enviado: 23-07-2022 Revisado: 08-10-2022 Aceptado: 01-12-2022 Publicado: 02-12-2022
Editor:
PhD.
Prof. Neela Satheesh ![]()
Autor para la correspondencia: Carlos Jefferson Valdiviezo Rogel *
ABSTRACT
Biomolecules such as: DNA, proteins, lipids (lipid peroxidation) are altered during oxidative stress where molecules (malondialdehyde) are released product of the decomposition of endoperoxides creating diseases. This work was based on the determination of the antioxidant capacity of the husks of cocoa on the lipid peroxidation in biological systems using TBARS methodology. Quality control analysis were performed, for the quantification of malondialdehyde, 6 groups with 4 animals were formed, I-control, II-induction, III - vitamin A, IV. V.VI - flour (100, 50 and 25 mg/kg), 24 hours earlier acetylsalicylic acid was administered as lipid peroxidation inducer, livers were extracted, a homogenate was prepared to react with TBA producing a colored complex, determining absorbance at 535 nm. Microbiological results determined absence of microorganisms, physicochemical results determined absence of flavonoids and polyphenols 1748 AGE mg / 100g. In 25, 50, 100 mg/kg dose, the reduction of malondialdehyde was: 0,322, 0,261,0,418 µM respectively.
Keywords: Antioxidant; Endoperoxides; Homogenate; Lipid Peroxidatioin; Malondialdehyde.
RESUMEN
Biomoléculas como: ADN, proteínas, lípidos (peroxidación lipídica) se alteran durante el estrés oxidativo donde se liberan moléculas (malondialdehído) producto de la descomposición de endoperóxidos creando enfermedades. Este trabajo se basó en la determinación de la capacidad antioxidante de la cascarilla de cacao sobre la peroxidación lipídica en sistemas biológicos utilizando la metodología TBARS. Se realizaron análisis de control de calidad, para la cuantificación de malondialdehído, se formaron 6 grupos con 4 animales, I-control, II-inducción, III - vitamina A, IV. V.VI - harina (100, 50 y 25 mg/kg), 24 horas antes se administró ácido acetilsalicílico como inductor de la peroxidación lipídica, se extrajeron los hígados, se preparó un homogeneizado para reaccionar con TBA produciendo un complejo coloreado, determinando absorbancia a 535 nm. Los resultados microbiológicos determinaron ausencia de microorganismos, los resultados fisicoquímicos determinaron ausencia de flavonoides y polifenoles 1748 AGE mg / 100g. En dosis de 25, 50, 100 mg/kg, la reducción de malondialdehído fue: 0,322, 0,261,0,418 µM respectivamente.
Palabras clave: Antioxidante; Endoperóxidos; Homogenato; Lipoperoxidación; Malondialdehído.
INTRODUCCIÓN
Según un estudio desde la década de los setenta se ha producido un incremento notable en las áreas de investigación destinadas a los radicales libres y sustancias con capacidad antioxidante. La formación de estos radicales se da por procesos tales como: radiaciones, iones metálicos, drogas; originando el deterioro u oxidación de biomoléculas como ADN, proteínas, lípidos o partes de la célula como la membrana celular.(1,2) Teniendo un papel en formación de algunas enfermedades degenerativas como: cardiovasculares, aceleración del envejecimiento y en el mayor de los casos cáncer.(3)
Para la Organización Mundial de la Salud el cáncer es una de las principales causas de morbilidad y mortalidad en todo el mundo, reportando en el 2014 unos 14 millones de casos nuevos y 8,2 millones de muertes relacionadas con el cáncer; de los cuales aproximadamente el 30 % de estas muertes se deben a factores naturales.(4,5) En la región de América la Organización Panamericana de la Salud registró en el mismo año unos 2,8 millones de casos nuevos y 1,3 millones de muertes a consecuencia del cáncer, de las cuales el 47 % se produjeron en América Latina y el Caribe.(6,7)
El Ministerio de Salud Pública del Ecuador dio a conocer que el cáncer tiene una incidencia creciente, por lo que ocupa la segunda causa de mortalidad después de las enfermedades cardiovasculares. El Instituto Nacional de Estadística y Censo registró 13 092 ingresos hospitalarios.(8) En base a la incidencia se ha realizado una enorme inversión para fortalecer la atención a pacientes con enfermedades oncológicas, implementando consultas y atenciones ambulatorias.(9)
El daño oxidativo de los lípidos se denomina lipoperoxidación (LP), la cual afecta principalmente a los lípidos de las membranas, durante este proceso se generan diversas especies que pueden ser consideradas marcadores del proceso, entre los cuales se encuentra el Malondialdehído (MDA), un aldehído de bajo peso molecular que se forma durante la descomposición de endoperóxidos en las últimas etapas de la LP.(10,11)
El malondialdehído es utilizado comúnmente como marcador empleando la metodología de sustancias reactivas al ácido tiobarbitúrico (TBARS), esta consiste en la reacción entre el MDA y el TBA en un medio con pH ácido y a altas temperaturas, donde dos moléculas de TBA reaccionan con una molécula de MDA, formando un complejo coloreado que puede ser medido colorimétricamente a 532 nm.(12,13)
Gracias al excelente clima tropical y las extensas tierras cultivables que posee el Ecuador, es que ha podido desempeñarse como un país netamente agrícola, siendo el cultivo de cacao una parte representativa de este sector, produciéndose aproximadamente 200 000 toneladas métricas al año ubicándose en la sexta posición entre los países productores de cacao a nivel mundial.(14) De los cuales, el 93,2 % se exporta y el 6,8 % se destina al consumo nacional según publicación de la Agencia Pública de Noticias del Ecuador y Suramérica.(15,16)
La cascarilla de cacao ha sido objeto de pocos estudios, algunos de estos demostraron que posee propiedades nutritivas, en la que se destaca una importante actividad antioxidante, y una de las maneras más eficientes de aprovechar estos antioxidantes e incorporarlos a la dieta de las personas es por medio de una infusión. Otra parte de la cáscara se utiliza, como material de combustible para calderas, materia prima para abono y en el mejor de los casos como alimento para pequeños mamíferos, mientras que otra parte es desperdiciada y desechada.(17,18)
Todo alimento que se emplee para el consumo humano debe pasar por diversas pruebas de inocuidad, con la finalidad de asegurar la obtención de un producto sano, nutritivo y libre de contaminantes. Para que la cascarilla de cacao pueda usarse como materia prima en infusiones debe realizarse una caracterización físico-química, calidad microbiológica y evaluar la presencia de toxinas que predominan en los cultivos de las semillas y granos.(19,20)
Teniendo en cuenta, lo expresado anteriormente, el fin de este trabajo fue determinar la actividad antioxidante de la cascarilla de cacao en polvo proporcionada por la Facultad de Ingeniería Química de la Universidad de Guayaquil, cuantificando la cantidad de radical malondialdehído producido en la lipoperoxidación en sistemas biológicos, para lo cual se realizó adicionalmente pruebas físico-químicas y microbiológicas que garantizaron la inocuidad del producto, pudiendo ser utilizado en infusiones, suplementos dietéticos etc.
¿Cuál es el efecto de los compuestos antioxidantes presentes en la cascarilla de cacao frente a radicales libres generados en la lipoperoxidacion como el malondialdehído en animales de experimentación?
Objetivo
Evaluar el efecto de la harina de cacao obtenida de las cascarillas sobre la lipoperoxidación en animales de experimentación.
MÉTODO
Se emplearon métodos teóricos, como el hipotético-deductivo ya que se planteó la hipótesis de la harina obtenida de las cascarillas de cacao tiene actividad antioxidante, para lo cual se determinó la cantidad de malondialdehído, producto final de la lipoperoxidación que reacciona con el ácido tiobarbitúrico.
Métodos empíricos como el observacional-experimental, porque se determinó la capacidad antioxidante de la harina obtenida de las cascarillas de cacao en la lipoperoxidación utilizando hígados de ratones, administrando diferentes tratamientos con diferentes dosis, con el fin de establecer la dosis terapéutica máxima.
Se aplicaron métodos estadísticos descriptivos como media y desviación estándar, con el fin de controlar la dispersión de los resultados que se obtenían, además se empleó una curva de distribución relacionando las absorbancia obtenidas de la actividad del malondialdehído con las concentraciones de harina que se emplearon. El Tipo de investigación del presente trabajo correspondió un estudio correlacional debido a que se midieron variables: dependientes como la concentración de malondialdehído, e independientes como la dosis y tratamientos.
El modelo experimental que se siguió fue el planteado por un estudio, el cual permitió establecer la comparación entre grupos controles a los que se le indujo la lipoperoxidación con la administración de ácido acetilsalicílico y otro sin tratamiento alguno; frente a grupos experimentales a los cuales se les administró vitaminas A y C, y diferentes dosis de harina obtenida de las cascarillas de cacao, sin haberse realizado pruebas previas.
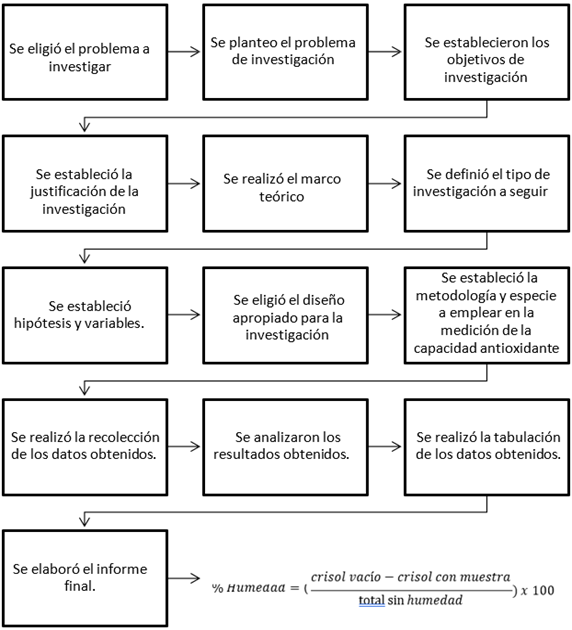
Figura 1. Metodología
Obtención de materia prima: para los ensayos de caracterización de la materia prima (harina de cacao) se utilizaron muestras de cascarilla de Cacao en polvo proporcionadas por la Facultad de Ingeniería Química de la Universidad de Guayaquil, la misma que forma parte del trabajo de titulación. Cuyos autores son Calderón Yagual Verónica y Noriega Rubio Viviana (Obtención de harina de los residuos de frutas con mayor poder antioxidante y antimicrobiano; maracuyá, cacao y plátano).
Las muestras se prepararon a través de una molienda hasta un tamaño de partícula menor al diámetro del tamiz 315 nm, manteniéndose almacenadas en envases al vacío durante la realización de los análisis, para evitar posibles cambios en la composición.
Análisis organoléptico
Se realizó un análisis sensorial al polvo obtenido de las cascarillas de las semillas de cacao, donde se observó, un color marrón, sabor y olor característicos a cacao, en base a la NORMA.
Granulometría
Para la determinación del tamaño de partícula del polvo obtenido de las cascarillas de cacao se procedió a seguir la metodología planteada en la norma INEN 0517, donde se pesó 100 g de la muestra en una balanza precisa Shimadzu Aux 220, luego se transfirió la muestra a una columna de tamices de diferentes tamaños (45, 70, 80 µm), donde el tamiz de mayor abertura se colocó en parte superior y el de menor quedo en el fondo, se agito durante cinco minutos, después de esto se desintegraron los aglomerados y en función del peso de la muestra retenida en cada tamiz se calculó el tamaño de partícula.
Humedad
Para la determinación de humedad en la cascarilla de cacao se empleó el método que describe la Norma COVENIN 1575-80, donde se procedió a pesar 3,00g de la muestra y colocados en una estufa al vacío en condiciones de 25 mmHg y 105°C, por 2 horas hasta alcanzar un peso constante. El porcentaje de humedad se calculó a partir de las diferencias de peso entre la muestra inicial y la deshidratada.
Cenizas totales
La cantidad de cenizas totales se determinó usando la norma INEN 0520, (2013), primero se calentaron los crisoles vacíos en la mufla a 600°C, durante 30 minutos, posterior se enfriaron en el desecador y se procedió a pesar 3g de muestra, luego se colocaron los crisoles con el contenido en la mufla a 600°C por 3 horas, o hasta obtener cenizas de un color gris. El contenido de ceniza se calculó a partir de las diferencias de peso entre la muestra inicial y la muestra final.
![]()
Contenido de grasa
Para la extracción de grasa de la muestra se realizó una hidrolisis utilizando hexano, para lo cual se pesaron 3,50g de la muestra en tubos Eppendorf, se le añadió 20 ml de hexano y se agitó en Vortex de 1 a 2 minutos, se llevó a baño maría por 5 minutos a 40°C, luego se procede a centrifugar. Se separó el líquido sobrenadante en una fiola previamente tarada; se evaporó el hexano (hasta sequedad) en una estufa por 1 hora a 60°C, se enfrió y por gravimetría se calculó el contenido de grasa.
![]()
Proteína total
Esta prueba se la realizó en el Laboratorio WSS, donde se empleó la metodología descrita en la norma INEN 0465, (2009), la cual determina el contenido de fibra bruta mediante el método de Kjeldahl.
Fibra cruda
Para el análisis del contenido de fibra cruda se pesaron 2,5 g de muestra y se colocó en una fiola de 500 ml, se agregó 150 ml de ácido sulfúrico al 1,5 % y llevado a un reflujo a 400°C durante 30 minutos a partir de ebullición, se sacaron y dejaron enfriar. Luego se traspasó el contenido en tubos Eppendorf y se procedió a lavar de 4 a 5 veces con agua destilada mediante centrifugación. Se transfirió el precipitado a una fiola y agregó 150 ml de hidróxido de sodio al 1,25 %, se calentó a 370°C durante 30 minutos a partir de ebullición.
Posteriormente se sacó y filtró enseguida en papel filtro lavando 4 veces con agua destilada, 3 veces con alcohol y un poco de éter. Se separó del papel filtro lo que quedó de la muestra y transfirió a una caja Petri verificando que no quede nada en el papel para evitar pérdida de muestra. Se llevó a la estufa a 100°C por 1 hora hasta que pierda humedad. La pérdida de peso después de la calcinación representa el contenido de fibra cruda.

Determinación de glúcidos
Mediante el método fenol-ácido sulfúrico, para lo cual se procedió a pesar 0,200g de muestra en un matraz con 50ml de etanol, se llevó a reflujo por 1 hora, luego se filtró y lavó con 20ml de etanol caliente y se llevó a otro reflujo durante 2 horas con agua caliente, se filtró y se transfirió el contenido a un matraz volumétrico de 250ml realizando 2 lavados con agua caliente y se enrasó.
Posteriormente se tomó una alícuota de 0,4 ml de la solución anterior, 1ml de agua destilada, 1ml de fenol al 5 %, 4ml de H2SO4 concentrado y se dejó en reposo durante 10 minutos, luego se llevó a baño maría a 40°C durante 15 minutos, se dejó enfriar y se leyó en el espectro a una absorbancia de 490nm. Se realizó a la vez una curva de calibración de una solución de glucosa al 0,08 mg/ml.
Contenido de fenoles totales Para la cuantificación de fenoles totales en la harina de cascarillas de cacao se utilizó el método de Folin-Ciocalteau de García, E., Fernández, I donde se prepararon los extractos a partir de cada muestra, para lo cual se pesan 500mg de muestra recién molida y se le realizan dos extracciones sucesivas de una hora con metanol-agua 80:20 v/v acidificando con HCl al 1 % a temperatura ambiente, se transfirió el contenido a tubos Eppendorf, se homogenizo en Vortex y se centrifugo a 10000rpm durante 15 minutos.
La curva de calibración se construyó a partir de una disolución madre de ácido gálico de 100mg/L, a partir de esta disolución se prepararon 10 ml de disoluciones diluidas de concentraciones crecientes de ácido gálico entre 0 y 16 ppm. Se tomaron 250 µl de cada disolución de ácido gálico y sobrenadante procedente de la extracción en matraces aforados de 25ml, se añadieron 15ml de agua destilada y 1,25ml de reactivo de Folin-Ciocalteau, se homogenizo el contenido de los matraces y dejo en reposo durante 8 minutos en oscuridad.
Transcurrido este tiempo se adiciono a cada matraz 3,75ml de una disolución de carbonato sódico al 7,5 % y se llevó a volumen con agua destilada, se homogenizo y dejo en reposo durante dos horas a temperatura ambiente. Las lecturas se realizaron en un espectrofotómetro UV-Visible Genesys 6 Thermo Scientific a una longitud de onda 765 nm. Adicionalmente se preparó un blanco de reactivos. Los resultados de este ensayo se expresaron en mg AGE (Ácido Gálico Equivalente)/100g de muestra.

Para determinación de flavonoides se pesó 0,500 g de muestra en tubos Eppendorf y se agregaron 25 ml de etanol al 80 %, se centrifugo a 10000rpm durante 15 minutos, posterior a esto se tomó una alícuota de 0,4 ml del sobrenadante y se transfirió a un matraz de 10 ml, se le agregaron 200µl de acetato de potasio 1M más 200µl de nitrato de aluminio al 10 %, se llevó a volumen con etanol 80 %, se dejó reposar durante 40 minutos y se procedió a leer en un espectrofotómetro UV-Visible Genesys 6 Thermo Scientific a 415 nm.
Análisis Microbiológicos
En el análisis microbiológico de la harina obtenida de las cascarillas de cacao se llevó a cabo el recuento de microorganismos aerobios mesófilos, coliformes totales y mohos y levaduras.
Mesófilos aerobios
Para la realización de este ensayo se empleó el método para recuento de colonias de bacterias aerobias en placas de Petri según la norma COVENIN, (1987), la cual consiste en la siembra en profundidad en un medio de cultivo Plate Count Agar (de Laboratorio Cevallos) vertidos en placas de Petri, con 1 ml de dilución a concentraciones 10-1, 10-2, 10-3. Luego se dejó en incubación por 48 horas a una temperatura de 37°C. Transcurrido este tiempo, se procedió a contar las colonias obtenidas en las placas de Petri y se calculó el número de microorganismos por gramo de muestra.
Coliformes totales
Para realizar esta prueba se desarrolló el método para el recuento de bacterias coliformes en placas de Petri según la norma COVENIN, (1984) en la cual se realizó la siembra en profundidad de 1ml de dilución a concentraciones 10-1, 10-2, 10-3, en un medio de Agar violeta rojo bilis en una placa de Petri. La incubación de las placas se realizó a 37°C por 48 horas. Luego de haber trascurrido este tiempo se contaron las colonias formadas.
Mohos y levaduras
Para esta prueba se siguió la metodología para recuento de mohos y levaduras descrita en la norma COVENIN, (1990), que se basa en la siembra en superficie en un medio de cultivo Agar Papa Dextrosa (PDA) repartidos en placas de Petri. Para la siembra se utilizaron 100ul de diluciones a 10-2, 10-3, 10-4. La incubación de las placas se realizó a condiciones de 25°C durante 5 días. A partir del número de colonias obtenidas se calculó el número de levaduras y mohos por gramo de muestra.
Modelo Experimental
La presente investigación se llevó a cabo en el Bioterio de la Facultad de Ciencias Químicas de la Universidad de Guayaquil. El método a seguir es el que se encuentra referido por un estudio “metodología TBARS, la cual consiste en la reacción entre el MDA y el TBA, en un pH ácido y a altas temperaturas, donde dos moléculas de TBA reaccionan con una molécula de MDA, formando un complejo coloreado que es medido espectrofotométricamente a 532nm.
Animales
Se utilizaron ratones machos CD-1 con un buen estado de salud en general, entre 8 a 10 semanas de nacidos con un peso promedio de 30g, los cuales fueron proporcionados por el Instituto Nacional De Investigación en Salud Pública (INSPI) ver anexo 5, y trasladados al Bioterio de la Facultad.
Condiciones ambientales y Conformación de grupos
Los animales fueron sometidos a un periodo de climatización por varios días con las siguientes condiciones ambientales: temperatura de 23-25 0C y humedad de 30- 70 %, se los mantuvo en jaulas plásticas con tapa metálica y acceso libre a agua y comida. Para una mejor observación dentro de los grupos, los animales fueron identificados con una marca única en el rabo.
Se los organizó en seis grupos de cuatro animales, previamente pesados en una (balanza Shimadzu AUX 220), para la administración de los diferentes tratamientos en base a la dosis correspondiente de acuerdo al peso (ver tabla 1).
|
Tabla 1. Tratamientos utilizados para medir la actividad antioxidante de las cascarillas de cacao en polvo |
|||
|
Grupos |
Inducción |
Tratamientos |
|
|
I |
Control |
Homogenato |
|
|
II |
Inducción de la lipoperoxidación |
Homogenato + ácido acetil salicílico |
------------- |
|
III |
Control positivo |
Homogenato + ácido acetil salicílico |
Vitamina A |
|
IV |
Harina 1 |
Homogenato + ácido acetil salicílico |
120 µl |
|
V |
Harina 2 |
Homogenato + ácido acetil salicílico |
60 µl |
|
VI |
Harina 3 |
Homogenato + ácido acetil salicílico |
30 µl |
Peroxidación lipídica o Lipoperoxidación
Para la realización de este ensayo se realizaron modificaciones a los modelos descritos por un estudio, donde a los animales se les administró por vía oral los diferentes tratamientos (los polifenoles presentes en la harina se concentraron a través de una evaporación etanólica) y ácido acetil salicílico (inductor de la lipoperoxidación) 3 días previos al ensayo final. Transcurrido este tiempo se administró nuevamente los tratamientos y después de una hora se procedió a dar eutanasia a los animales para la extracción del hígado, estos requirieron ayuna entre 4-6 horas previas.
Obtención del homogenato de mitocondrias y generación de lipoperoxidación microsómica in vitro
Después de realizar la eutanasia a los animales, se extrajeron los hígados de cada uno de los animales y se lavaron con NaCl al 0,9 % en un baño de hielo a 4°C durante 10 minutos, luego se procedió a triturar los hígados y pesar 1g de tejido en tubos de centrifuga con 9ml de KCl al 1,15 %, se homogenizo y centrifugo a 6000rpm durante 30 minutos. Se descartó líquido sobrenadante y se pesó 0,1mg del sedimento en tubos de centrifuga y se adicionó 2,4ml del amortiguador fosfato de potasio 50mM a un pH de 7,4, 150 µl de cloruro férrico 600µM y 150ml de ascorbato de sodio 1mM.
Posteriormente, la mezcla se incubó durante 30 minutos en un baño termorregulador con agitación constante, la reacción se detuvo mediante la precipitación de las proteínas al agregar 1500 µl de ácido tricloroacético 20 % P/V en baño de frío a 4°C, la mezcla se centrifugo a 15000rpm durante 10 minutos.
Metodología para la detección de productos finales de la LP de membranas plasmáticas TBARS
Se tomaron 1200µl de la fracción enriquecida (líquido sobrenadante) y se agregó 1500µl de ácido tiobarbitúrico al 1 %P/V, la mezcla se homogenizo e incubo en un baño termorregulador a 50°C durante 60 minutos con agitación constante. El complejo formado por MDA y TBA produjo una reacción colorimétrica de color rosa a la que se determinó su absorbancia en un espectrofotómetro UV/Vis A 535NM.
Análisis físico-químicos y microbiológicos de la cascarilla de cacao en polvo (harina)
Análisis físico-químicos
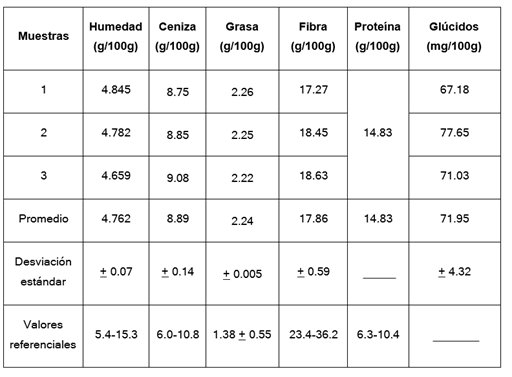
En la figura 2 se presentan los resultados obtenidos de los análisis físico-químicos realizados a la harina de las cascarillas de cacao, con el promedio y desviación estándar de los triplicados.
Fuente: los valores referenciales son reflejados en la EFSA, 2008
Figura 2. Análisis físico-químicos de las muestras de cascarillas de cacao en polvo
Se observa que el contenido de humedad de la cascarilla están en un promedio de 4,76 %, valores similares a los reportados por un estudio y menores a los que indican Calderon y Noriega y la EFSA, esta variable está afectada por el proceso térmico previo al descascarillado y por el secado de la harina, por lo que hubo una pérdida de agua previo al análisis.
El contenido de cenizas totales esta entre un 8-9 % valores mucho mayores a los que reportan Calderon y Noriega pero concuerda con los reportados por Soto y están dentro de los valores referenciados por la EFSA, la cuantificación de cenizas además de poseer interés nutricional, como factor de control de calidad en cuanto a contaminación e impurezas se puedan presentar en la materia prima y es un parámetro de importancia en la elaboración de infusiones restringido por la norma COVENIN 1980 de infusiones, que permite un máximo del 10 %, por lo tanto la harina obtenida de las cascarillas de cacao cumple con este requisito.
El contenido de grasas encontrado fue de un 2,22-2,26 %, estudios previos realizados a la cascarilla de cacao presenta un bajo contenido de lípidos alrededor de 1 al 6 % según un estudio lo que se pudo corroborar con los resultados obtenidos, similares a los reportados por Soto.
El contenido de fibra cruda varía entre un 17-18 % valores superiores a los reportados por Calderon y Noriega y por debajo de los valores referenciados en la EFSA, 2008, esto depende de las condiciones en la se obtuvo la materia prima, o también puede ser porque en el proceso de análisis se va perdiendo cierta cantidad de contenido en las centrifugadas o filtradas.
El contenido de proteína está en un 14,83 %, valores por encima de los reportados por la EFSA, 2008 y menor al obtenido por Soto, que están entre 18-19 %. El contenido de glúcidos esta entre un 67-77 %, los estudios de Lecumberri y Cardona et al. reportan valores cercanos al 70 %, lo que se asemeja a los encontrados en la muestra de cascarilla de cacao (véase figura 3).
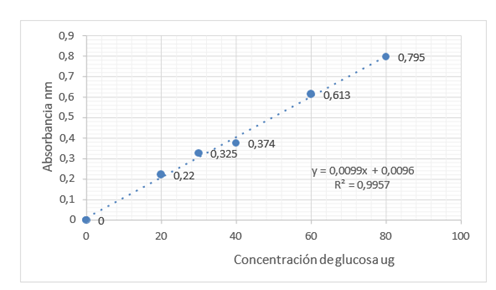
Figura 3. Curva de glúcidos
Es importante recordar que las muestras de cascarillas de cacao (harina) analizadas fueron procesadas y proporcionadas por la Facultad de Ingeniería Química, cuyo origen son centrales agrícolas del Cantón Naranjal, lo que incluye un gran número de variables que pueden afectar la cuantificación del contenido proximal de la muestra y provocar diferencias en los resultados de los mismos, condiciones de cultivo, tiempo de secado, tiempo de almacenaje, condiciones de procesamiento de la materia prima.
Propiedades físico-químicas
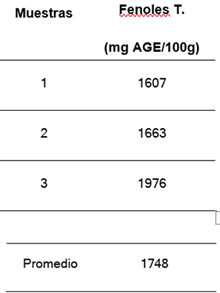
Figura 4. Contenido de polifenoles de las muestras de cascarilla de cacao en polvo
Los valores de fenoles son mayores en la muestra 3, en datos reportados por un estudio, el contenido de polifenoles en la cascarilla de cacao presenta valores cercanos a los 6000mg/100g de muestra, al compararlos con los obtenidos en el ensayo, estos últimos están significativamente por debajo de los reportados. Esta variación en los valores puede deberse a distintas causas como las condiciones de procesamiento de la materia prima, condiciones de almacenaje, etc.
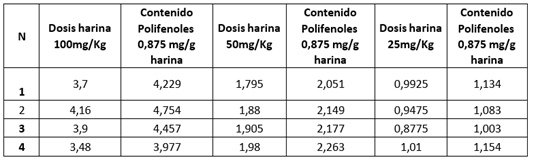
Figura 5. Tratamiento con harina
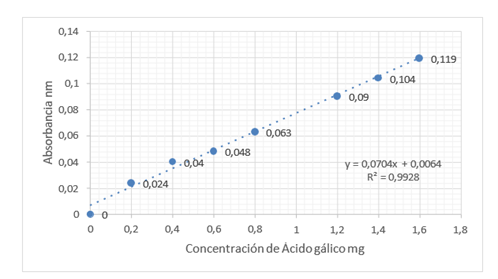
Figura 6. Curva de fenoles totales
En cuanto al contenido de flavonoides, estos presentaron absorbancias inferiores que no entraban en la curva de calibración, por lo que se deduce que el contenido es mínimo o nulo.
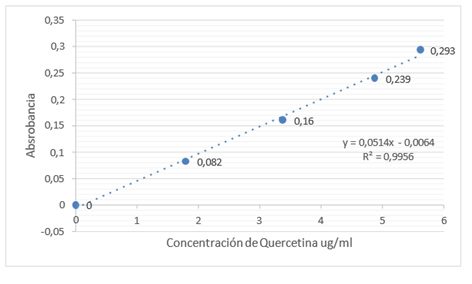
Figura 7. Curva de flavonoides
Análisis microbiológico
En la figura se muestran los resultados de las determinaciones de mesófilos aerobios, coliformes totales, mohos y levaduras en la harina obtenida de las cascarillas de cacao. Solo se observa la presencia de aerobios mesófilos en las muestras, ya que estos microorganismos se encuentran en los alimentos de manera extensa debido a que las condiciones para su desarrollo con proporcionadas por el medio ambiente fácilmente.
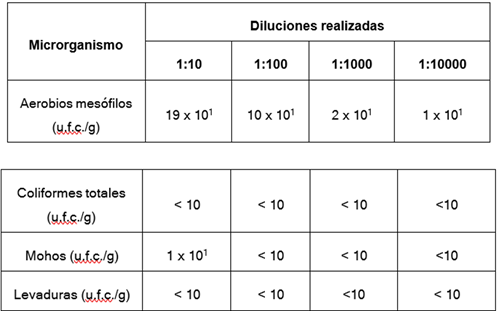
Figura 7. Resultados microbiológicos obtenidos en la harina de la cascarilla de cacao
Este tipo de análisis sirve para monitorear la implementación de buenas prácticas de manufactura BPM, la eficiencia de los procesos aplicados, condiciones de higiene del equipo y utensilios, condiciones de almacenamiento y distribución.
En base a la normativa INEN 0620 que establece los requisitos microbiológicos que debe cumplir el cacao en polvo para consumo humano, los resultados obtenidos están dentro de los valores permitidos por la norma INEN, si el fin de la harina es para materia prima de infusiones, estos deben cumplir con los criterios mostrados por la EFSA en el Anexo, 4, los resultados obtenidos en las primeras diluciones muestra una diferencia de 50 u.f.c. por encima de lo establecido para la cascarilla de cacao.
Sin embargo, estos microorganismos en general no provocan enfermedades en el ser humano y su presencia no causa un deterioro significativo en los alimentos, si se lleva a cabo en condiciones y tiempo de almacenaje adecuado. Por estas razones no es necesaria la aplicación de algún proceso que disminuya la presencia de estos microorganismos en la harina de cascarilla de cacao para consumo humano.
La concentración de malondialdehído se determinó a partir de la reacción con el TBARS formando un complejo coloreado que se determinó espectrofotométricamente a 535 nm, dichas concentraciones se reflejan en la Figura 8.
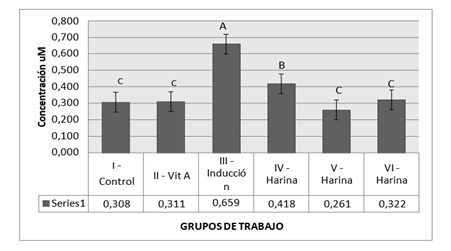
Figura 8. Concentración de MDA/mg de proteína
Letras iguales en columna no presentan diferencia significativa
En relación a las concentraciones obtenidas se puede establecer, luego del análisis estadístico (ANOVA), los grupos IV y V que recibieron la dosis de 25, y 50 mg/kg, guardan relación con el grupo normal (no tratado) y el control positivo (Vitamina A), pero difieren del grupo inducido AAS (sin tratamiento).
La dosis de 25mg/kg es la que presentó mayor respuesta en comparación a las demás, según estudios realizados en ratas indican que los diferentes grupos de polifenoles difieren en estructura polimérica, confiriéndoles un alto peso molecular, el cual limita su absorción en el intestino, una vez absorbidos están sujetos a procesos de detoxificación metabólica, que incluyen modificaciones como metilación, sulfatación y glucuronidación. Las concentraciones de polifenoles en el plasma son muy variables y es necesario ingerirlos reiteradamente para mantener concentraciones elevadas de polifenoles en el plasma.
Estos procesos aumentan la hidrofilicidad del compuesto y facilitan de esa manera la excreción por vía urinaria o biliar. Las frecuencias de estas modificaciones están condicionadas por la naturaleza y la dosis de polifenoles ingeridos. La actividad antioxidante y prooxidantes de los polifenoles está condicionada en base a su estructura y concentración que se encuentren, siendo que a dosis bajas proporcionan efectos beneficiosos y dosis altas puedan causar daño a nivel celular, en este caso aumentando los niveles de malondialdehído. Esta es la razón por la que la dosis de 25 mg/kg presentó mejor respuesta frente a la dosis de 100mg/kg.
En cuanto a la carga antioxidante reportada por Calderon y Noriega a una concentración de 100 µll, la harina de cacao es la que presentó mayor carga antioxidante con un 75,96 en comparación a la de maracuyá (58,92) y plátano (36,92). Afirmando los resultados obtenidos en la presente investigación.
CONCLUSIONES
Se determinó las características físicos químicos de la harina de cacao en lo que se obtuvo un promedio de porcentaje de: humedad 4,762, ceniza, 8,89, grasa 2,24 g/100g, los mismos que están dentro de los rangos de análisis físicos químicos de las muestras de cascarilla de cacao en polvo según la tabla EFSA (Autoridad Europea de Seguridad Alimentaria). Por otro lado en los análisis microbiológicos los mesófilos aerobios se obtuvo 19 x 101UFC, mientras que coliformes totales son menores a 10, mohos y levaduras 1 x 101 se encuentran dentro del rango de la tabla EFSA.
Se determinó la concentración de polifenoles totales (método de Folin Ciocalteu) teniendo un resultado de 0,875mg/g harina, mientras que hubo ausencia de flavonoides.
Se evaluó un modelo experimental de daño oxidativo en el Bioterio de la Facultad de Ciencias Químicas. Para esto fue necesario realizar adaptaciones en la metodología del ácido tiobarbitúrico (TBARS), que permite medir la concentración del malondialdehído (producto final de la peroxidación) con la inducción del ácido acetilsalicílico (agente hepatotóxico) lo que permitió establecer la actividad antioxidante de los polifenoles presentes en la cascarilla de cacao.
REFERENCIAS BIBLIOGRÁFICAS
1. Alvarés D. Método Químico DPPH para determinar la capacidad antioxidante presente en una mermelada [Internet]. Guayaquil; 2013 [cited 2016 Nov 28]. Available from: [URL].
2. AOAC 923.03. Método Gravimétrico para determinación de cenizas totales [Internet]. 1990 [cited 2017 Feb 12]. Available from: [URL].
3. Armijos A. Características de ácidez como parámetro químico de calidad en muestras de cacao. Quito, Ecuador: 2002 [cited 2017 Jan 12]. Available from: [URL].
4. Avello M, Suwalsky M. Radicales Libres, Antioxidantes Naturales y Mecanismos de Protección. Scholarly Journals. 2006;(494):161-72. Available from: https://search.proquest.com/docview/199584586?accountid=131412.
5. Baena L. Obtención y caracterización de fibra dietética a partir de cascarilla de las semillas tostadas de Theobroma cacao L. de una industria chocolatera colombiana [Internet]. Pereira: Universidad Tecnológica de Pereira; 2012 [cited 2017 Feb 25]. Available from: http://repositorio.utp.edu.co/dspace/handle/11059/3036.
6. Bhooshany K, Rizzi A. Plant polyphenols as dietary antioxidants in human health and disease. Oxid Med Cell Longev. 2011;2(5):270-8.
7. Braudeau J. El cacao. Barcelona, España: Blume; 1970.
8. Calderón V, Noriega V. Obtención de harina de los residuos de frutas con mayor poder antioxidante y antimicrobiano (maracuyá, cacao y plátano). Guayaquil: Universidad de Guayaquil, Facultad de Ingeniería Química; 2017.
9. Chévez D. Caracterización físico-química y sensorial de treinta élites de cacao [Internet]. Redalyc; 2015 [cited 2017 Feb 6]. Available from: [URL].
10. Contesse. Evaluación de la lipoperoxidación in vitro, a través de las reacciones del 3-metil-2-benzotiazolidon hidrazona (MBTH) y del ácido tiobarbitúrico (TBARS). Santiago: Universidad de Chile; 2010.
11. Bryant C, Hamaker B. Effect of lime on gelatinization of corn flour and starch. Cereal Chem. 1997;74(2):171-5.
12. Cristancho L, Monroy R. Determinación de carbohidratos totales por espectrometría UV [Internet]. Tunja: Universidad Pedagógica y Tecnológica de Colombia; 2012 [cited 2017 Oct 18]. Available from: https://es.slideshare.net/LeidyCristancho/manual-de-mtodos-generales-para-determinacin-de-carbohidratos.
13. Crosbie G. The relationship between starch swelling properties, paste viscosity and boiled noodle quality in wheat flours. J Cereal Sci. 1991;13:145-50.
14. ECORAE. Compendio de recomendaciones tecnológicas para los principales cultivos de la Amazonía ecuatoriana. Quito, Ecuador: 2001.
15. EFSA. European Food Safety Authority [Internet]. 2008 [cited 2017 Feb 5]. Available from: [URL].
16. García E, Fernández I. Determinación de polifenoles totales por el método de Folin-Ciocalteu. Valencia: Universidad Politécnica de Valencia; 2015.
17. Gómez M. Estudios de transporte in vitro de flavonoides y biodisponibilidad en humanos. Madrid: Universidad Complutense de Madrid; 2015.
18. Gutiérrez V. Daño oxidativo, radicales libres y antioxidantes. Med Milit. 2002;2(31):26-33.
19. Hernández J. Mecanismos antioxidantes enzimáticos [Internet]. CEBAS-CSIC; 2013 [cited 2017 Feb 5]. Available from: https://cienciacebas.wordpress.com/2013/01/30/mecanismos-antioxidantes-de-defensa-ii-mecanismos-enzimaticos/.
20. Huerta M, Ortega E, Cobos M, Herrera J. Estrés oxidativo y el uso de antioxidantes en animales domésticos. Scholarly Journals. 2005;12:728-34.
FINANCIACIÓN
Ninguna.
CONFLICTO DE INTERÉS
Los autores declaran que no existe conflicto de interés.
CONTRIBUCIÓN DE AUTORÍA
Conceptualización: Carlos Jefferson Valdiviezo Rogel, Pilar Asunción Soledispa Cañarte, Francisca Patricia Jimenez Granizo, Glenda Marcela Sarmiento Tomalá, Zoraida Burbano Gómez, Alexandra López Barrera.
Curación de datos: Carlos Jefferson Valdiviezo Rogel, Pilar Asunción Soledispa Cañarte, Francisca Patricia Jimenez Granizo, Glenda Marcela Sarmiento Tomalá, Zoraida Burbano Gómez, Alexandra López Barrera.
Análisis formal: Carlos Jefferson Valdiviezo Rogel, Pilar Asunción Soledispa Cañarte, Francisca Patricia Jimenez Granizo, Glenda Marcela Sarmiento Tomalá, Zoraida Burbano Gómez, Alexandra López Barrera.
Investigación: Carlos Jefferson Valdiviezo Rogel, Pilar Asunción Soledispa Cañarte, Francisca Patricia Jimenez Granizo, Glenda Marcela Sarmiento Tomalá, Zoraida Burbano Gómez, Alexandra López Barrera.
Metodología: Carlos Jefferson Valdiviezo Rogel, Pilar Asunción Soledispa Cañarte, Francisca Patricia Jimenez Granizo, Glenda Marcela Sarmiento Tomalá, Zoraida Burbano Gómez, Alexandra López Barrera.
Administración del proyecto: Carlos Jefferson Valdiviezo Rogel, Pilar Asunción Soledispa Cañarte, Francisca Patricia Jimenez Granizo, Glenda Marcela Sarmiento Tomalá, Zoraida Burbano Gómez, Alexandra López Barrera.
Recursos: Carlos Jefferson Valdiviezo Rogel, Pilar Asunción Soledispa Cañarte, Francisca Patricia Jimenez Granizo, Glenda Marcela Sarmiento Tomalá, Zoraida Burbano Gómez, Alexandra López Barrera.
Software: Carlos Jefferson Valdiviezo Rogel, Pilar Asunción Soledispa Cañarte, Francisca Patricia Jimenez Granizo, Glenda Marcela Sarmiento Tomalá, Zoraida Burbano Gómez, Alexandra López Barrera.
Supervisión: Carlos Jefferson Valdiviezo Rogel, Pilar Asunción Soledispa Cañarte, Francisca Patricia Jimenez Granizo, Glenda Marcela Sarmiento Tomalá, Zoraida Burbano Gómez, Alexandra López Barrera.
Validación: Carlos Jefferson Valdiviezo Rogel, Pilar Asunción Soledispa Cañarte, Francisca Patricia Jimenez Granizo, Glenda Marcela Sarmiento Tomalá, Zoraida Burbano Gómez, Alexandra López Barrera.
Visualización: Carlos Jefferson Valdiviezo Rogel, Pilar Asunción Soledispa Cañarte, Francisca Patricia Jimenez Granizo, Glenda Marcela Sarmiento Tomalá, Zoraida Burbano Gómez, Alexandra López Barrera.
Redacción – borrador original: Carlos Jefferson Valdiviezo Rogel, Pilar Asunción Soledispa Cañarte, Francisca Patricia Jimenez Granizo, Glenda Marcela Sarmiento Tomalá, Zoraida Burbano Gómez, Alexandra López Barrera.
Redacción – revisión y edición: Carlos Jefferson Valdiviezo Rogel, Pilar Asunción Soledispa Cañarte, Francisca Patricia Jimenez Granizo, Glenda Marcela Sarmiento Tomalá, Zoraida Burbano Gómez, Alexandra López Barrera.