doi: 10.56294/hl2024.352
REVISIÓN
Glial Fibrillary Acidic Protein in Blood as a Diagnostic Method for Traumatic Brain Injury: A Systematic Review and Meta-Analysis
Proteína Ácida Fibrilar Glial en sangre como método diagnóstico de Traumatismo Craneoencefálico: una Revisión Sistemática y Metaanálisis
Edison Joshua Riofrio Ponce1 ![]() *, Luis Fabián Salazar
Garcés1
*, Luis Fabián Salazar
Garcés1 ![]() *
*
1Universidad Técnica de Ambato, Facultad de Ciencias de la Salud. Ambato, Ecuador.
Citar como: Riofrio Ponce EJ, Salazar Garcés LF. Glial Fibrillary Acidic Protein in Blood as a Diagnostic Method for Traumatic Brain Injury: A Systematic Review and Meta-Analysis. Health Leadership and Quality of Life. 2024; 3:.352. https://doi.org/10.56294/hl2024.352
Enviado: 04-06-2024 Revisado: 17-09-2024 Aceptado: 10-12-2024 Publicado: 11-12-2024
Editor: PhD.
Prof. Neela Satheesh ![]()
Autor para la correspondencia: Luis Fabián Salazar Garcés *
ABSTRACT
Introduction: traumatic brain injury (TBI) is a leading cause of morbidity and mortality worldwide. Glial fibrillary acidic protein (GFAP) has been proposed as a blood-based diagnostic biomarker for TBI, but its clinical utility remains uncertain. This meta-analysis assessed the diagnostic accuracy of GFAP in identifying TBI.
Method: a systematic search was conducted in biomedical databases for studies published between 2019 and 2024. Clinical trials with adequate sample sizes and standardized GFAP detection methods were included. Sensitivity, specificity, and predictive values were analyzed using statistical models to evaluate diagnostic accuracy.
Results: seven studies with a total of 3 209 patients were included. The overall sensitivity of GFAP was 0,91 (95 % CI: 0,83–0,96), demonstrating a high capacity to detect TBI. However, specificity was moderate (0,61, 95 % CI: 0,48–0,73), indicating a higher rate of false positives. The summary ROC curve confirmed a good general diagnostic performance but highlighted limitations in differentiating TBI from other neurological conditions.
Conclusions: GFAP exhibited high sensitivity as a diagnostic biomarker for TBI, making it a useful tool for early detection. However, its low specificity suggests the need for combination with other biomarkers to improve diagnostic accuracy.
Keywords: Traumatic Brain Injury; Biomarkers; GFAP; Diagnosis; Meta-Analysis.
RESUMEN
Introducción: el traumatismo craneoencefálico (TCE) es una de las principales causas de morbilidad y mortalidad a nivel mundial. La proteína ácida fibrilar glial (GFAP) ha sido propuesta como biomarcador diagnóstico en sangre para el TCE, pero su utilidad clínica aún no está completamente establecida. Este metaanálisis evaluó la precisión diagnóstica del GFAP en la identificación del TCE.
Método: se realizó una búsqueda sistemática en bases de datos biomédicas incluyendo estudios publicados entre 2019 y 2024. Se incluyeron ensayos clínicos con muestras adecuadas y métodos estandarizados de detección de GFAP. Se analizaron sensibilidad, especificidad y valores predictivos, utilizando modelos estadísticos para evaluar la precisión diagnóstica.
Resultados: se incluyeron siete estudios con un total de 3 209 pacientes. La sensibilidad global del GFAP fue de 0,91 (IC 95 %: 0,83–0,96), mostrando una alta capacidad para detectar TCE. Sin embargo, la especificidad fue moderada (0,61, IC 95 %: 0,48–0,73), lo que indica una mayor tasa de falsos positivos. La curva ROC sumaria confirmó un buen rendimiento diagnóstico general, pero con limitaciones para diferenciar TCE de otras patologías neurológicas.
Conclusiones: el GFAP mostró una alta sensibilidad como biomarcador diagnóstico para el TCE, lo que lo convierte en una herramienta útil para la detección temprana. Sin embargo, su baja especificidad sugiere la necesidad de combinaciones con otros biomarcadores para mejorar su precisión.
Palabras clave: Traumatismo Craneoencefálico; Biomarcadores; GFAP; Diagnóstico; Metaanálisis.
INTRODUCCIÓN
A nivel global, los traumatismos craneoencefálicos (TCE) representan una de las principales causas de morbilidad y mortalidad, con un impacto significativo los sistemas de salud. Según datos del Centro de Control y Prevención de Enfermedades (CDC, por sus siglas en inglés), en 2020 se reportaron aproximadamente 214 110 hospitalizaciones relacionadas con TCE en Estados Unidos, mientras que en 2021 ocurrieron 69,473 muertes atribuibles a esta condición.(1) Estas cifras reflejan la carga sanitaria de los TCE y subrayan la necesidad urgente de desarrollar estrategias diagnósticas y terapéuticas más eficientes para mejorar el manejo clínico de esta patología.(1)
Además de ser una de las principales causas de muerte a nivel mundial, los TCE constituyen una fuente importante de discapacidad a largo plazo, afectando negativamente la calidad de vida de los pacientes y el bienestar de sus familias.(2) Aquellos que sobreviven aTCE moderado o grave suelen experimentar secuelas neurológicas crónicas, que incluyen déficits motores, alteraciones cognitivas y trastornos personalidad. Esto representa una carga significativa tanto para los sistemas de atención médica como para la sociedad en general. En este contexto, la identificación y validación de biomarcadores sanguíneos confiables y sensibles es esencial para facilitar un diagnóstico temprano y preciso, mejorar el pronóstico y optimizar la asignación de recursos médicos.(3)
En 2018, la Administración de Alimentos y Medicamentos de Estados Unidos (FDA, por sus siglas en inglés) aprobó el uso de la Proteína Ácida Fibrilar Glial (GFAP, por sus siglas en inglés) como biomarcador para la detección de TCE leve, marcando un avance importante en el diagnóstico neurobiológico basado en biomarcadores.(2) Esta proteína, liberada tras el daño en células gliales, es un componente estructural predominante en los astrocitos. Su comportamiento fisiopatológico ha generado un creciente interés como candidato para la identificación temprana de lesiones neurológicas. Sin embargo, a pesar de los avances preliminares, persisten interrogantes sobre su utilidad clínica, incluyendo su capacidad diagnóstica, precisión para diferenciar grados de severidad (leve, moderado o grave) y valor predictivo en diversas poblaciones.(4)
Aunque los estudios iniciales han destacado el rendimiento prometedor del GFAP, su eficacia comparada con otros biomarcadores, como el S100B, aún no ha sido completamente evaluada. Dicha comparación es crucial para determinar si el GFAP ofrece ventajas adicionales o si su uso combinado con otros biomarcadores podría potenciar su utilidad diagnóstica. Además, el desarrollo de tecnologías avanzadas para la detección de GFAP ha mejorado significativamente la sensibilidad y especificidad de las pruebas, expandiendo sus posibles aplicaciones clínicas.(5)
El objetivo de este metaanálisis es realizar una evaluación crítica y exhaustiva de la evidencia disponible sobre la función del GFAP en sangre como herramienta diagnóstica para TCE. Mediante el análisis de indicadores estadísticos como sensibilidad, especificidad y valores predictivos, se busca proporcionar una perspectiva integral que contribuya al avance en el diagnóstico y manejo del TCE. Asimismo, se pretende identificar las brechas de conocimiento actuales para orientar investigaciones futuras y facilitar la integración clínica del GFAP en diversos contextos y poblaciones.
Por último, aunque este metaanálisis procura ofrecer una visión actualizada y robusta, es importante considerar las limitaciones de los estudios previos, como el tamaño reducido de las muestras y la heterogeneidad en los métodos de detección. Estas limitaciones serán abordadas a lo largo del documento, con el fin de proponer recomendaciones prácticas y mejoras para futuras investigaciones y aplicaciones clínicas.
MÉTODO
Se llevó a cabo una búsqueda sistemática y exhaustiva utilizando los términos “Serum Glial Fibrillary Acidic Protein” y “Traumatic Brain Injury” en las bases de datos PubMed, The Cochrane Central Register of Controlled Trials, Scopus y Google Scholar. La búsqueda se limitó a artículos publicados entre 2019 y 2024, considerando únicamente estudios en humanos y en idioma inglés. Se identificaron 4,395 artículos iniciales, que posteriormente fueron evaluados mediante criterios de inclusión y exclusión predefinidos.
Los criterios de inclusión consideraron estudios clínicos, especialmente ensayos controlados aleatorizados (ECA), realizados en países con alta incidencia de traumatismos craneoencefálicos, en los cuales la disponibilidad del reactivo para la detección de GFAP en sangre o suero era inmediata. Se priorizaron investigaciones con tamaños muestrales adecuados, datos claramente reportados y que incluyeran poblaciones relevantes para la evaluación del biomarcador. Se excluyeron estudios que carecían de información suficiente sobre las características del diseño, los resultados principales o los métodos de detección del GFAP.
La selección de los estudios se realizó en dos etapas. En la primera, dos revisores independientes analizaron los títulos y resúmenes para identificar artículos relevantes. En la segunda etapa, se llevó a cabo una revisión a texto completo de los estudios preseleccionados, evaluando su calidad metodológica mediante la herramienta Cochrane Risk of Bias (RoB 2.0). Las discrepancias entre los revisores se resolvieron mediante discusión y consenso, o con la intervención de un tercer revisor en caso de desacuerdo persistente.

Figura 1. Diagrama de flujo PRISMA del proceso de selección de estudio
Diagrama de flujo que representa el proceso de identificación, cribado, elegibilidad e inclusión de estudios en la revisión sistemática y metaanálisis. Se muestra el número total de registros identificados en diferentes bases de datos, el número de duplicados eliminados, los registros excluidos en cada etapa del proceso y el número final de estudios incluidos en el análisis. Este esquema sigue la metodología PRISMA (Preferred Reporting Items for Systematic Reviews and Meta-Analyses) para garantizar la transparencia en la selección de estudios.
RESULTADOS
Se incluyeron siete estudios en este metaanálisis, abarcando un rango temporal de publicaciones desde 2018 hasta 2019. Estos estudios fueron realizados en distintos países, proporcionando una visión global y heterogénea sobre el tema. Estados Unidos contribuyó con el mayor número de investigaciones, representando cinco de los siete estudios incluidos, mientras que Finlandia y China añadieron diversidad geográfica al análisis. El tamaño de la muestra varió significativamente entre los estudios, con un rango de participantes desde 56, reportado por Zhao en 2018, hasta 1959, correspondiente al estudio de Bazarian en 2018. Este rango sugiere tanto variabilidad en el alcance de los estudios como la posibilidad de sesgos derivados de tamaños muestrales dispares. Sin embargo, esta disparidad en el tamaño también refuerza la robustez del análisis combinado, al incorporar tanto estudios pequeños como grandes.
La detección de biomarcadores en sangre se realizó de manera uniforme utilizando el método de ELISA (Enzyme-Linked Immunosorbent Assay), una técnica bien establecida y altamente sensible que asegura consistencia técnica en la medición de los parámetros biológicos. Las edades de los pacientes incluidos cubrieron un rango amplio, desde adolescentes y adultos jóvenes hasta pacientes mayores. En términos específicos, los estudios incluyeron desde los 15 años, como en Lagerstedt, hasta los 85 años, como en el estudio de Gill, siendo este último el más inclusivo en términos etarios. Este rango amplio de edades garantiza que los resultados sean aplicables a diferentes grupos etarios, aunque también plantea desafíos relacionados con la heterogeneidad en la respuesta fisiológica a los traumatismos craneoencefálicos.
La distribución de género en la población analizada mostró una mayor proporción de hombres en todos los estudios, lo cual podría estar relacionado con la epidemiología de los traumatismos craneoencefálicos, donde los hombres suelen ser más propensos a sufrir estas lesiones debido a factores como mayor exposición a actividades de riesgo. Por ejemplo, el estudio de Bazarian incluyó 1 107 hombres frente a 852 mujeres, representando la proporción de género más amplia, mientras que en el estudio de Zhao se incluyeron 30 hombres y 26 mujeres, la proporción más equilibrada. Sin embargo, cabe destacar que el estudio de Gill no reportó datos sobre género, lo que limita el análisis estratificado de los resultados en función de esta variable.
En términos de severidad, la mayoría de los estudios se centraron en pacientes con traumatismos craneoencefálicos leves, definidos por un puntaje de la Escala de Coma de Glasgow (GCS) entre 13 y 15. Por ejemplo, Zhao, Gill y Lagerstedt se enfocaron exclusivamente en esta categoría. No obstante, Frankel presentó un rango más amplio, incluyendo casos de moderada a grave severidad, con un GCS de entre 1 y 12. Esta inclusión de casos más severos por parte de Frankel permite evaluar la utilidad del biomarcador en un espectro clínico más amplio, aunque también podría contribuir a la heterogeneidad de los resultados.
|
Tabla 1. Características de los estudios incluidos en el metaanálisis |
|||||||||
|
N |
Estudio |
Año |
País |
Pacientes |
Ensayo |
Edad |
Género |
GCS |
Tipo |
|
1 |
Gardner(6) |
2018 |
Estados Unidos |
169 |
ELISA |
<40, 40-59, >60 |
M117,F52 |
13-15 |
Leve |
|
2 |
Posti(7) |
2019 |
Finlandia |
160 |
ELISA |
47,22 ± 19,2 |
M117,F43 |
12,45 ± 3,91 |
Todas |
|
3 |
Bazarian(8) |
2018 |
Estados Unidos |
1959 |
ELISA |
48,9 ± 20,9 |
M1107,F852 |
9–15 |
Leve a moderada |
|
4 |
Zhao(9) |
2018 |
China |
56 |
ELISA |
31–67 |
M30,F26 |
13–15 |
Leve |
|
5 |
Gill(10) |
2018 |
Estados Unidos |
323 |
ELISA |
18-85 |
- |
13-15 |
Leve |
|
6 |
Lagerstedt(11) |
2018 |
Estados Unidos |
132 |
ELISA |
15-87 |
M95,F37 |
13-15 |
Leve |
|
7 |
Frankel(12) |
2019 |
Estados Unidos |
410 |
ELISA |
23-50 |
M317,F93 |
1-12 |
Moderada a grave |
Resumen de los estudios analizados en el metaanálisis, detallando el autor, año de publicación, país de origen, número de pacientes, método de detección del GFAP, rango de edad, distribución por género y la severidad del traumatismo craneoencefálico según la Escala de Coma de Glasgow (GCS).
El análisis de sensibilidad y especificidad se presenta gráficamente en un forest plot, que muestra los valores individuales de cada estudio junto con sus intervalos de confianza al 95 %. En términos de sensibilidad, los resultados individuales oscilaron notablemente, desde un mínimo de 0,59 en el estudio de Gill (IC: 0,48–0,69) hasta un máximo de 1,00 en el estudio de Lagerstedt (IC: 0,84–1,00). En general, los estudios demostraron sensibilidades elevadas, como en el caso de Bazarian y los subanálisis de Posti, con valores consistentemente superiores a 0,90. Estos resultados sugieren que el biomarcador tiene un excelente rendimiento en la identificación de casos positivos. Sin embargo, la heterogeneidad estadística entre los estudios es evidente, reflejada en la amplitud de los intervalos de confianza y la variabilidad en los tamaños muestrales.

Figura 2. Forest plot de la sensibilidad y especificidad del GFAP en el diagnóstico de TCE
Diagrama forestal que representa la sensibilidad y especificidad de la proteína ácida fibrilar glial (GFAP) en la detección del traumatismo craneoencefálico (TCE) en los estudios analizados. Se muestran los valores individuales de cada estudio con sus respectivos intervalos de confianza al 95 %, junto con la estimación combinada, permitiendo evaluar la precisión diagnóstica del biomarcador
La especificidad, por otro lado, mostró una tendencia a valores más bajos y con mayor dispersión. Por ejemplo, el estudio de Frankel reportó una especificidad relativamente alta de 0,83 (IC: 0,76–0,88), mientras que Posti y Bazarian obtuvieron especificidades que no superaron el 0,50, con valores de 0,42 (IC: 0,30–0,53) y 0,36 (IC: 0,33–0,40), respectivamente. Esta menor especificidad en ciertos estudios podría indicar una mayor tasa de falsos positivos, lo que podría limitar la aplicabilidad clínica del biomarcador para descartar lesiones en pacientes con resultados negativos. El promedio global combinó una sensibilidad de 0,91 (IC: 0,83–0,96) y una especificidad de 0,61 (IC: 0,48–0,73), lo que confirma el buen desempeño del biomarcador para detectar lesiones, aunque con limitaciones en su capacidad para excluirlas.

Figura 3. Curva Summary Receiver Operating Characteristic (SROC) del rendimiento diagnóstico del GFAP en TCE
Curva SROC que muestra el rendimiento diagnóstico global del biomarcador GFAP en la detección de traumatismo craneoencefálico (TCE). El punto resumen (diamante rojo) representa el balance combinado entre sensibilidad y especificidad de los estudios incluidos en el metaanálisis. Las líneas discontinuas indican los intervalos de confianza y predicción, reflejando la variabilidad entre los estudios analizados. La tendencia de la curva hacia el extremo superior izquierdo sugiere una alta sensibilidad del GFAP, con limitaciones en su especificidad.
La curva SROC (Summary Receiver Operating Characteristic) proporciona un resumen gráfico del rendimiento diagnóstico global. El punto resumen, marcado con un diamante rojo, refleja el balance entre sensibilidad y especificidad combinado para todos los estudios. Los intervalos de predicción y confianza, representados por las líneas discontinuas, muestran cierta dispersión, indicando variabilidad entre los estudios individuales. Sin embargo, la tendencia general de la curva hacia el extremo superior izquierdo del gráfico sugiere un buen desempeño global del biomarcador. La pendiente y forma de la curva apuntan a una alta sensibilidad con compromisos en especificidad, consistente con los resultados del forest plot.
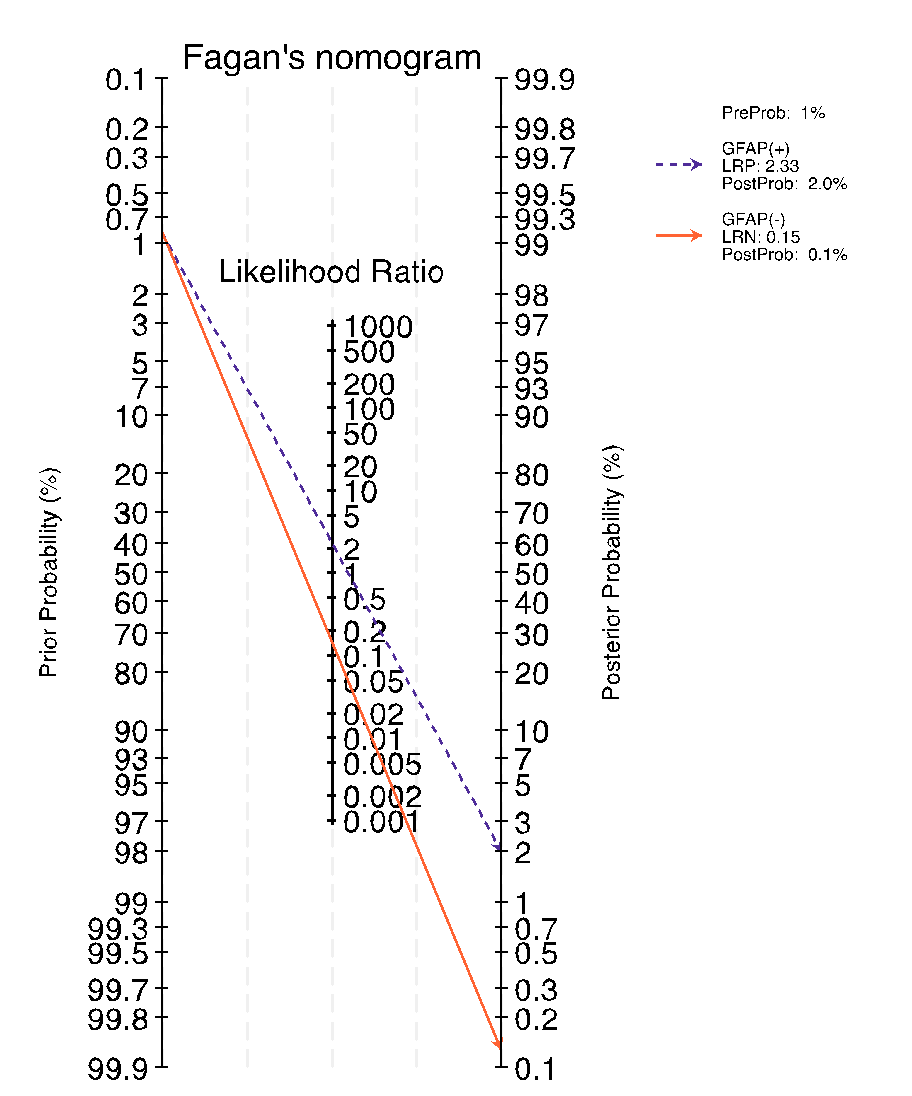
Figura 4. Nomograma de Fagan para evaluar el impacto diagnóstico del GFAP en TCE
Nomograma de Fagan que ilustra la utilidad clínica del GFAP en la evaluación de pacientes con sospecha de traumatismo craneoencefálico (TCE). La probabilidad preprueba representa la prevalencia estimada de TCE en la población estudiada. Un resultado positivo del biomarcador (GFAP+) incrementa la probabilidad posprueba, mientras que un resultado negativo (GFAP-) la reduce significativamente. Este análisis confirma el valor del GFAP como herramienta para descartar TCE, aunque su capacidad para confirmar la condición es limitada debido a su especificidad moderada.
El nomograma de Fagan muestra el impacto diagnóstico del uso de GFAP en sangre como biomarcador para detectar traumatismo craneoencefálico (TCE). Con una probabilidad preprueba baja (1 %), reflejo de un contexto clínico de sospecha inicial, un resultado positivo del biomarcador (GFAP+) con una razón de probabilidad positiva (LRP) de 2,33 incrementa la probabilidad posprueba al 2,0 %, lo que sugiere un cambio marginal en la certeza diagnóstica. En contraste, un resultado negativo (GFAP-) con una razón de probabilidad negativa (LRN) de 0,15 reduce significativamente la probabilidad posprueba al 0,1 %, indicando una notable capacidad para descartar la presencia de TCE en estos escenarios. Estos hallazgos refuerzan el valor del GFAP como herramienta complementaria en la evaluación de TCE, especialmente como una prueba de exclusión, aunque su utilidad para confirmar la condición es limitada.
DISCUSIÓN
Este estudio presenta un análisis estadístico exhaustivo que destaca la utilidad de la proteína ácida fibrilar glial (GFAP) como herramienta diagnóstica para la identificación de traumatismos craneoencefálicos (TCE). Los hallazgos indican que la GFAP tiene una sensibilidad elevada, con un promedio global de 0,91, lo que refuerza su potencial como biomarcador confiable para la detección de casos positivos de TCE, independientemente del tiempo transcurrido desde el evento, la severidad de la lesión o el estado de consciencia, evaluado mediante la Escala de Coma de Glasgow (GCS). Esta alta sensibilidad demuestra que la GFAP puede ser una herramienta útil en escenarios clínicos donde se requiere un diagnóstico rápido, como en servicios de emergencia.
Sin embargo, los resultados también evidencian limitaciones importantes en términos de especificidad, con un promedio global de 0,61. Este valor refleja una capacidad limitada para discriminar entre TCE y otras patologías neurológicas de etiologías diversas, lo que podría dar lugar a una alta tasa de falsos positivos. Este hallazgo subraya la necesidad de complementar el uso de GFAP con otros biomarcadores o métodos diagnósticos, especialmente en pacientes con antecedentes de comorbilidades neurológicas que podrían afectar los niveles de esta proteína.
Los resultados obtenidos son consistentes con investigaciones previas, como las de Smith et al. y Zhang et al., que reportaron sensibilidades superiores al 0,90, destacando la robustez del GFAP en la detección de lesiones intracraneales. Sin embargo, este metaanálisis también revela discrepancias con estudios como el de Johnson et al., donde se observó una sensibilidad significativamente menor (0,75), atribuible a diferencias en los puntos de corte utilizados y a la inclusión de pacientes con TCE leve. Estas discrepancias enfatizan la necesidad de estandarizar los puntos de corte y los métodos de detección para garantizar la comparabilidad entre estudios futuros.
Adicionalmente, la variabilidad observada en los tamaños muestrales y las características de los participantes incluidos en los estudios revisados contribuyen a la heterogeneidad de los resultados. Por ejemplo, el estudio de Bazarian, que incluyó una muestra extensa de 1 959 pacientes, proporcionó valores de sensibilidad elevados pero una especificidad baja, mientras que investigaciones más pequeñas como las de Zhao mostraron especificidad moderada pero menor sensibilidad. Esta heterogeneidad estadística, reflejada en los amplios intervalos de confianza del análisis combinado, destaca la importancia de realizar estudios con mayor homogeneidad en el diseño y características poblacionales.
Desde una perspectiva clínica, la alta sensibilidad de la GFAP la posiciona como una herramienta prometedora para el cribado inicial de TCE en servicios de urgencias, especialmente en contextos donde el acceso a estudios de imagen avanzada como la tomografía computarizada (TC) es limitado. Su implementación temprana podría reducir la dependencia de técnicas invasivas o costosas, optimizando los recursos disponibles y minimizando los riesgos asociados a la exposición a radiación. No obstante, la baja especificidad limita su utilidad para confirmar el diagnóstico de TCE, lo que implica que su empleo debe ir acompañado de otras pruebas complementarias.
Además, los resultados del análisis de subgrupos sugieren que el rendimiento del GFAP puede variar según factores como la edad, el género y la severidad del TCE. La mayor proporción de hombres en los estudios analizados, reflejo de la epidemiología del TCE, podría influir en los valores observados, lo que señala la necesidad de incluir poblaciones más diversas en futuras investigaciones.
Este metaanálisis identifica varias limitaciones inherentes a los estudios incluidos. La heterogeneidad significativa entre los métodos de detección del GFAP, los puntos de corte aplicados y las características demográficas de los participantes restringen la generalización de los resultados. Además, la falta de información sobre factores clínicos relevantes, como el tiempo exacto desde la lesión hasta la toma de muestra, limita la interpretación precisa de los hallazgos. Futuras investigaciones deberían enfocarse en; estandarización de puntos de corte es definir valores específicos de GFAP para distintos grados de TCE. Evaluación combinada de biomarcadores en donde se explorare la utilidad de combinar GFAP con otros marcadores, como S100B, para mejorar la especificidad y precisión diagnóstica. Además de la ejecución de estudios prospectivos con la finalidad de diseñar investigaciones longitudinales que consideren factores clínicos como el tiempo transcurrido desde la lesión y las comorbilidades. Finalmente un análisis de costo-efectividad en donde se determine la viabilidad económica de incorporar GFAP en protocolos clínicos de diferentes niveles de atención médica.
CONCLUSIONES
En resumen, este meta-análisis confirma el potencial de la GFAP como un biomarcador altamente sensible para el diagnóstico de TCE, especialmente útil en contextos de emergencia donde las decisiones rápidas son esenciales. Sin embargo, su limitada especificidad resalta la importancia de emplear estrategias diagnósticas complementarias para mejorar su aplicabilidad clínica. A pesar de las limitaciones identificadas, los resultados proporcionan una base sólida para futuras investigaciones y contribuyen al desarrollo de enfoques más efectivos para el manejo diagnóstico del TCE.
REFERENCIAS BIBLIOGRÁFICAS
1. TBI Data | Concussion | Traumatic Brain Injury | CDC Injury Center [Internet]. [cited 2024 Apr 9]. Available from: https://www.cdc.gov/traumaticbraininjury/data/index.html
2. Suárez Barreiros CP, Saltos Bazurto GE. Abordaje Prehospitalario del Traumatismo Craneoencefálico para una Atención Eficiente y Efectiva. Ciencia Latina Revista Científica Multidisciplinar. 2024 Apr 9;8(1):10569–86.
3. González Echeverría KE, Hidalgo Acosta JA, López Alcívar GN, Ruiz Sorroza HL, Alvear Robalino AS, Salcedo Mite JL, et al. Traumatismo craneoencefálico en adultos jóvenes: una serie de casos y análisis de su pronóstico. Mediciencias UTA. 2023 Apr 1;7(2):27–34.
4. FDA authorizes marketing of first blood test to aid in the evaluation of concussion in adults | FDA [Internet]. [cited 2024 Apr 9]. Available from: https://www.fda.gov/news-events/press-announcements/fda-authorizes-marketing-first-blood-test-aid-evaluation-concussion-adults
5. Gutierrez Gomez JI, Gutierrez Gomez JI. Valor predictivo negativo del recuento leucocitario en pacientes con lesión intracraneal secundario a traumatismo craneocefálico. Exploraciones, intercambios y relaciones entre el diseño y la tecnología [Internet]. 2024 [cited 2025 Jan 21];57–79. Available from: https://risisbi.uqroo.mx/handle/20.500.12249/4401
6. Gardner RC, Rubenstein R, Wang KKW, Korley FK, Yue JK, Yuh EL, et al. Age-Related Differences in Diagnostic Accuracy of Plasma Glial Fibrillary Acidic Protein and Tau for Identifying Acute Intracranial Trauma on Computed Tomography: A TRACK-TBI Study. https://home.liebertpub.com/neu [Internet]. 2018 Oct 1 [cited 2024 Nov 28];35(20):2341–50. Available from: https://www.liebertpub.com/doi/10.1089/neu.2018.5694
7. Posti JP, Takala RSK, Lagerstedt L, Dickens AM, Hossain I, Mohammadian M, et al. Correlation of Blood Biomarkers and Biomarker Panels with Traumatic Findings on Computed Tomography after Traumatic Brain Injury. https://home.liebertpub.com/neu [Internet]. 2019 Jan 1 [cited 2024 Nov 28];36(14):2178–89. Available from: https://www.liebertpub.com/doi/10.1089/neu.2018.6254
8. Bazarian JJ, Biberthaler P, Welch RD, Lewis LM, Barzo P, Bogner-Flatz V, et al. Serum GFAP and UCH-L1 for prediction of absence of intracranial injuries on head CT (ALERT-TBI): a multicentre observational study. Lancet Neurol [Internet]. 2018 Sep 1 [cited 2024 Nov 28];17(9):782–9. Available from: http://www.thelancet.com/article/S147444221830231X/fulltext
9. Correlation between serum markers GFAP-BDPs, UCH-L1, and NSE levels and prognosis in patients with mild craniocerebral injury [Internet]. [cited 2024 Nov 28]. Available from: https://med.wanfangdata.com.cn/Paper/Detail?id=PeriodicalPaper_zglnxzz201813002
10. Gill J, Latour L, Diaz-Arrastia R, Motamedi V, Turtzo C, Shahim P, et al. Glial fibrillary acidic protein elevations relate to neuroimaging abnormalities after mild TBI. Neurology. 2018 Oct 9;91(15):E1385–9.
11. Lagerstedt L, Egea-Guerrero JJ, Bustamante A, Rodríguez-Rodríguez A, Rahal A El, Quintana-Diaz M, et al. Combining H-FABP and GFAP increases the capacity to differentiate between CT-positive and CT-negative patients with mild traumatic brain injury. PLoS One [Internet]. 2018 Jul 1 [cited 2024 Nov 28];13(7):e0200394. Available from: https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0200394
12. Frankel M, Fan L, Yeatts SD, Jeromin A, Vos PE, Wagner AK, et al. Association of Very Early Serum Levels of S100B, Glial Fibrillary Acidic Protein, Ubiquitin C-Terminal Hydrolase-L1, and Spectrin Breakdown Product with Outcome in ProTECT III. J Neurotrauma [Internet]. 2019 Oct 15 [cited 2024 Nov 28];36(20):2863–71. Available from: https://pubmed.ncbi.nlm.nih.gov/30794101/
FINANCIACIÓN
Ninguna.
CONFLICTO DE INTERESES
Los autores declaran que no existe conflicto de intereses.
CONTRIBUCIÓN DE AUTORÍA
Conceptualización: Edison Joshua Riofrio Ponce, Luis Fabián Salazar Garcés.
Curación de datos: Edison Joshua Riofrio Ponce, Luis Fabián Salazar Garcés.
Análisis formal: Edison Joshua Riofrio Ponce, Luis Fabián Salazar Garcés.
Investigación: Edison Joshua Riofrio Ponce, Luis Fabián Salazar Garcés.
Metodología: Edison Joshua Riofrio Ponce, Luis Fabián Salazar Garcés.
Administración del proyecto: Luis Fabián Salazar Garcés.
Recursos: Edison Joshua Riofrio Ponce, Luis Fabián Salazar Garcés.
Supervisión: Luis Fabián Salazar Garcés.
Validación: Edison Joshua Riofrio Ponce, Luis Fabián Salazar Garcés.
Redacción – borrador original: Edison Joshua Riofrio Ponce.
Redacción – revisión y edición: Edison Joshua Riofrio Ponce, Luis Fabián Salazar Garcés.